题目内容
元素的性质在元素周期表中按其排列呈现一定的规律。下表为元素周期表中部分元素,根据要求回答下列问题:
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上12种元素分别属于s区、d区、ds区和p区,则属于s区的元素有 种,属于d区的元素有 种。
(3)铜晶胞是面心立方结构。其空间利用率为 (用含“π”和“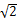 ”的式子表示,不必算结果)
”的式子表示,不必算结果)
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上12种元素分别属于s区、d区、ds区和p区,则属于s区的元素有 种,属于d区的元素有 种。
(3)铜晶胞是面心立方结构。其空间利用率为 (用含“π”和“
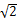 ”的式子表示,不必算结果)
”的式子表示,不必算结果)(1)钾,铬,铜(2)2 8 (3)π/ (3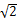 )
)
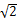 )
) 试题分析:(1)当原子核外各个轨道上的电子处于全充满、半充满、全空时是稳定的状态。在给定的元素中,K的核外电子排布为:1s22s22p63s23p64s1.最外层只有1个电子;Cr的核外电子排布为:1s22s22p63s23p63d54s1.最外层只有1个电子;Cu的核外电子排布为:1s22s22p63s23p63d104s1.最外层只有1个电子;因此在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有钾,铬,铜。(2)属于s区的元素有K、Ca两种元素;属于d区的元素有Sc、Ti、V、Cr、Mn、Fe、Co、Ni8种元素。(3)铜晶胞是面心立方结构。在每个晶胞中含有的Cu原子的个数为8×1/8+6×1/2=4.假设晶胞的边长为a,Cu原子的半径为R,则
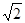 a=4R.a=2
a=4R.a=2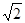 R.晶胞的体积为a3=16
R.晶胞的体积为a3=16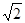 R3.4个Cu原子的体积为:4×4/3ПR3=16ПR3/3.所以在Cu晶体中的空间利用率为(16πR3/3)÷16
R3.4个Cu原子的体积为:4×4/3ПR3=16ПR3/3.所以在Cu晶体中的空间利用率为(16πR3/3)÷16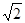 R3="π/" (3
R3="π/" (3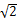 )。
)。
练习册系列答案
相关题目
 Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0