题目内容
为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将
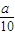 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol?L-1的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液.
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol?L-1的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液.请回答下列问题:
(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
______KMnO4+______FeSO4+______H2SO4=______Fe2(SO4)3+______MnSO4+______K2SO4+______H2O
(2)在滴定实验中不能选择______式滴定管,理由是______;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为______和______;(铁的相对原子质量以55.9计)
(4)高锰酸钾是化学中常用强氧化剂.在实验室中可用下式配制少量高锰酸钾溶液:
______Mn2++______NaBiO3+______H+=______MnO4-+______Bi3++______Na++______H2O
1)、配平系数
2)、根据以上信息,下列各组离子在溶液中不能大量共存的是______
A.Na+、K+、H+、Cl-、NO3-、MnO4- B.Na+、K+、H+、SO42-、BiO3-、Cl-
C.Na+、Al3+、H+、NO3-、SO42-、MnO4- D.Na+、K+、Mn2+、NO3-、SO42-、Cl-.
【答案】分析:(1)根据氧化还原反应遵循电子守恒和质量守恒配平化学方程式;
(2)根据高锰酸钾的强氧化性和乳胶管的易腐蚀性选择滴定管;
(3)根据方程式计算;
(4)根据离子方程式遵循电荷守恒、电子守恒和质量守恒进行配平;如离子能发生氧化还原反应、复分解反应、相互促进的水解反应则不能大量共存.
解答:解:(1)Mn由+7价降为+2价,Fe由+2价升为+3价,利用化合价升降法容易配平,2KMnO4~10FeSO4,根据质量守恒完成整个方程式,
故答案为:2、10、8、5、2、1、8;
(2)考查酸式滴定管、碱式滴定管的特点及使用条件,由于KMnO4具有强氧化性,会对乳胶管有腐蚀性.所以,用KMnO4溶液滴定时,选用酸式滴定管,
故答案为:碱;KMnO4是强氧化剂,它会腐蚀乳胶管;
(3)Fe+H2SO4=FeSO4+H2↑
55.9g 22.4L
ag×ω1 580×10-3L
ω1=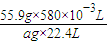 =
=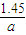
2KMnO4+8H2SO4+10FeSO4=2MnSO4+K2SO4+8H2O+5Fe2(SO4)3
2mol 10×56g
0.02000mol?L-1×25.00×10-3L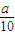 g×ω2
g×ω2
ω2=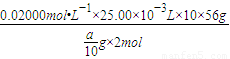 =
=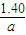
故答案为: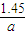 ;
;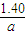 ;
;
(4)1)根据化合价的变化,Mn由+2价升为+7价,Bi由+5价降为+2价,利用化合价升降法容易配平,2Mn2+~5NaBiO3,再根据电荷守恒和质量守恒配平,
应为2Mn2++5NaBiO3+14H+=2MnO4-+5Bi3++5Na++7H2O,故答案为:2、5、14、2、5、5、7;
2)A、在酸性条件下MnO4- 离子氧化Cl-离子而不能大量共存,故A错误;
B、在酸性条件下BiO3-离子氧化Cl-离子而不能大量共存,故B错误;
C、D中离子之间不反应,能大量共存,
故答案为:AB.
点评:考查学生对实验原理的理解、实验操作的掌握、有关实验的计算、实验方案的评价等方面的能力,本题既是一道立足基础实验操作的试题,又是一道实验评价的试题,还是一道开放型试题.本题学科特色明显,难度不大,但对分析问题的能力要求较高.考查的知识在书中或在题内,但学生的学习、思维可以延伸到题外.可以说,本题彰显了新的课程理念,利于培养学生自学和深入思考的习惯.
(2)根据高锰酸钾的强氧化性和乳胶管的易腐蚀性选择滴定管;
(3)根据方程式计算;
(4)根据离子方程式遵循电荷守恒、电子守恒和质量守恒进行配平;如离子能发生氧化还原反应、复分解反应、相互促进的水解反应则不能大量共存.
解答:解:(1)Mn由+7价降为+2价,Fe由+2价升为+3价,利用化合价升降法容易配平,2KMnO4~10FeSO4,根据质量守恒完成整个方程式,
故答案为:2、10、8、5、2、1、8;
(2)考查酸式滴定管、碱式滴定管的特点及使用条件,由于KMnO4具有强氧化性,会对乳胶管有腐蚀性.所以,用KMnO4溶液滴定时,选用酸式滴定管,
故答案为:碱;KMnO4是强氧化剂,它会腐蚀乳胶管;
(3)Fe+H2SO4=FeSO4+H2↑
55.9g 22.4L
ag×ω1 580×10-3L
ω1=
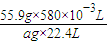 =
=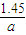
2KMnO4+8H2SO4+10FeSO4=2MnSO4+K2SO4+8H2O+5Fe2(SO4)3
2mol 10×56g
0.02000mol?L-1×25.00×10-3L
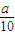 g×ω2
g×ω2ω2=
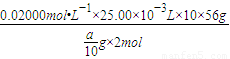 =
=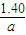
故答案为:
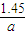 ;
;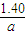 ;
;(4)1)根据化合价的变化,Mn由+2价升为+7价,Bi由+5价降为+2价,利用化合价升降法容易配平,2Mn2+~5NaBiO3,再根据电荷守恒和质量守恒配平,
应为2Mn2++5NaBiO3+14H+=2MnO4-+5Bi3++5Na++7H2O,故答案为:2、5、14、2、5、5、7;
2)A、在酸性条件下MnO4- 离子氧化Cl-离子而不能大量共存,故A错误;
B、在酸性条件下BiO3-离子氧化Cl-离子而不能大量共存,故B错误;
C、D中离子之间不反应,能大量共存,
故答案为:AB.
点评:考查学生对实验原理的理解、实验操作的掌握、有关实验的计算、实验方案的评价等方面的能力,本题既是一道立足基础实验操作的试题,又是一道实验评价的试题,还是一道开放型试题.本题学科特色明显,难度不大,但对分析问题的能力要求较高.考查的知识在书中或在题内,但学生的学习、思维可以延伸到题外.可以说,本题彰显了新的课程理念,利于培养学生自学和深入思考的习惯.

练习册系列答案
相关题目