题目内容
(1)1811年法国化学家库特瓦用硫酸处理海藻灰时发现了碘.碘单质通常状况下为
(2)1824年法国化学家巴拉尔用氯气处理提取食盐后的盐水母液时发现了溴.溴元素的99%存在于海洋,称作“海洋元素”,其化合物可用作镇静剂.溴的原子序数为35,其原子结构简图为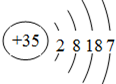
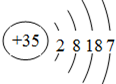 ;溴化钠中存在的化学键是
;溴化钠中存在的化学键是
 ,溴化钠的电离方程式为
,溴化钠的电离方程式为
紫黑
紫黑
色固体,其制剂可用来消毒和治疗甲状腺肿.碘缺乏病是目前已知的导致人类智力障碍的主要原因,因此碘元素称作“智慧元素”.碘的单质有两种特性,一是物理特性:易升华
易升华
;二是化学特性:遇淀粉显蓝色
遇淀粉显蓝色
.(2)1824年法国化学家巴拉尔用氯气处理提取食盐后的盐水母液时发现了溴.溴元素的99%存在于海洋,称作“海洋元素”,其化合物可用作镇静剂.溴的原子序数为35,其原子结构简图为
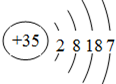
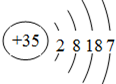
离子键
离子键
,在物理性质上表现出熔沸点较高、硬度较大
熔沸点较高、硬度较大
.氯化钠的电子式为

NaBr=Na++Br-
NaBr=Na++Br-
.检验某固体试样中是否有Br-的方法为取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在
取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在
.分析:(1)碘为紫黑色固体,易升华,淀粉遇碘变蓝色,是碘的特性,可用来检验碘;
(2)溴的原子序数为35,原子核外有4层电子,最外层电子数为7,NaBr为离子化合物,具有较高的熔沸点,与硝酸银反应生成浅黄色沉淀溴化银.
(2)溴的原子序数为35,原子核外有4层电子,最外层电子数为7,NaBr为离子化合物,具有较高的熔沸点,与硝酸银反应生成浅黄色沉淀溴化银.
解答:解:(1)碘为紫黑色固体,易升华,淀粉遇碘变蓝色,故答案为:紫黑;易升华,遇淀粉显蓝色;
(2)溴的原子序数为35,原子核外有4层电子,最外层电子数为7,原子结构示意图为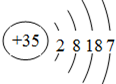 ,
,
NaBr和NaCl都为离子化合物,具有较高的熔沸点,NaBr为强电解质,电离方程式为NaBr=Na++Br-,NaCl的电子式为 ,溴化钠与硝酸银反应生成浅黄色沉淀溴化银,检验时,可取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在,
,溴化钠与硝酸银反应生成浅黄色沉淀溴化银,检验时,可取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在,
故答案为: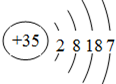 ;离子键;熔沸点较高、硬度较大;
;离子键;熔沸点较高、硬度较大; ; NaBr=Na++Br-;取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在.
; NaBr=Na++Br-;取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在.
(2)溴的原子序数为35,原子核外有4层电子,最外层电子数为7,原子结构示意图为
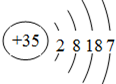 ,
,NaBr和NaCl都为离子化合物,具有较高的熔沸点,NaBr为强电解质,电离方程式为NaBr=Na++Br-,NaCl的电子式为
 ,溴化钠与硝酸银反应生成浅黄色沉淀溴化银,检验时,可取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在,
,溴化钠与硝酸银反应生成浅黄色沉淀溴化银,检验时,可取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在,故答案为:
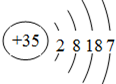 ;离子键;熔沸点较高、硬度较大;
;离子键;熔沸点较高、硬度较大; ; NaBr=Na++Br-;取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在.
; NaBr=Na++Br-;取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在.点评:本题考查卤素单质及其化合物的性质,题目难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目