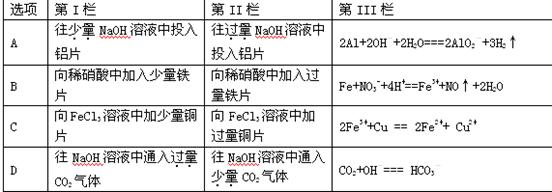
题目内容
下列离子方程式正确的是( )
NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l);△H=-57.3kJ/mol
| A.碳酸氢钠溶液与少量石灰水反应 HCO3-+ Ca2+ + OH- = CaCO3↓ + H2O |
| B.铁溶于稀硝酸,溶液变黄: Fe+4H++ NO3-="==" Fe3++ NO↑+2H2O |
| C.Na2CO3溶液显碱性:CO32-+H2O="==" HCO3-+OH- |
| D.已知稀溶液中,酸碱反应的中和热为57.3KJ/mol,则将浓度均为0.1mol/l的NaOH溶液与醋酸等体积混合时的热化学方程式为: |
B
A.碳酸氢钠溶液与少量石灰水反应,应为2HCO3-+ Ca2+ +2 OH- = CaCO3↓ + 2H2O+CO32-
,A错误。
B.铁溶于稀硝酸,溶液变黄,说明生成三价铁离子,B正确。
C.Na2CO3溶液显碱性,是因为碳酸根离子水解,应用可逆号,C错误。
D.醋酸为弱酸,电离过程会吸热,因此生成1mol水放出的热量会小于57.3KJ,△H>-57.3kJ/molD错误。
故选B
,A错误。
B.铁溶于稀硝酸,溶液变黄,说明生成三价铁离子,B正确。
C.Na2CO3溶液显碱性,是因为碳酸根离子水解,应用可逆号,C错误。
D.醋酸为弱酸,电离过程会吸热,因此生成1mol水放出的热量会小于57.3KJ,△H>-57.3kJ/molD错误。
故选B

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O