题目内容
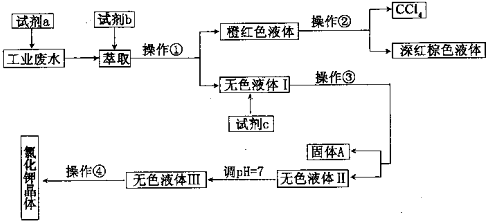
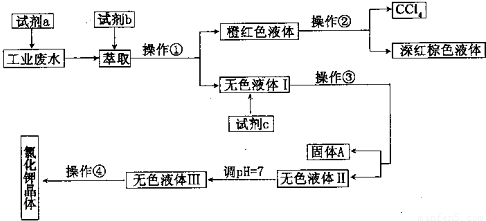
某厂排放的废液中含有大量的K+、Cl-、Br-,还含有少量的Ca2+、Mg2+、SO2-4.某研究性学习小组拟取这种工业废水来制取较纯净的氯化钾晶体及液澳,他们设计了如下的流程: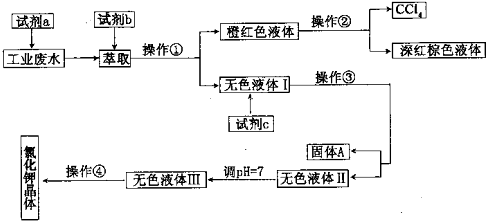
可供试剂a、b、c选择的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液BaCl2溶液、Ba(NO3)2溶液、苯、CCl4、H2O2溶液、KMnO4(H+)溶液.
根据以上流程回答相关问题:
(1)试剂a、b分别是______、______.
(2)操作①、②、③、④的名称是(填字母序号)
a.过滤、分液、过滤、蒸发结晶 b.分液、蒸馏、过滤、蒸发结晶
c.分液、过滤、过滤、蒸发结晶 d.分液、分液、过滤、蒸发结晶
(3)除去无色液体I中的Ca2+、Mg2+、SO-24离子,选出e所代表的试剂,按滴加顺序依次是______(只填化学式).
(4)调节pH的作用是______;操作方法是______.
(5)操作④中用到的瓷质仪器名称是______.
解:(1)向工业废水中加试剂a能生成橙红色的液体溴,所以a应有氧化性,且和溴离子反应不引进新的杂质,a还应有氧化性,所以a是双氧水;要想使溴从溶液中萃取出来,所选用的萃取剂必须是和水不互溶的液体,且溴在萃取剂中的溶解度大于在水中的溶解度,所以试剂b是四氯化碳,
故答案为:H2O2;CCl4;
(2)分离两种不相溶的液体的操作是分液,所以操作①是分液;分离两种互溶的液体采用蒸馏的方法,所以操作②是蒸馏;分离不溶性的固体和液体的方法是过滤,所以操作③是过滤;从溶液中制得晶体的方法是蒸发结晶,故操作④是蒸发结晶,
故答案为:b;
(3)本实验是制取氯化钾,所以除杂的试剂应选含有钾离子或氯离子的物质,所以除去钙离子应选用碳酸钾溶液,除去镁离子应选氢氧化钾溶液,除去硫酸根离子应选用氯化钡溶液;应先除去硫酸根离子,多余的钡离子用碳酸根离子除去,所以先滴加氯化钡溶液;然后滴加碳酸钾溶液,除去溶液中的钙离子和钡离子;最后加氢氧化钾溶液,除去溶液中的镁离子,多余的氢氧根离子和碳酸根离子用调节溶液PH值的方法除去,
故答案为:BaCl2、K2CO3、KOH;
(4)除去溶液中的钙离子和镁离子后,溶液中有过量的氢氧根离子和碳酸根离子,它们属于杂质离子,应除去,所以调节溶液的PH值以除去溶液中过量的氢氧根离子和碳酸根离子.
测定溶液PH值的方法是:取少量的PH试纸置于玻璃片上,用蘸有待测溶液的玻璃棒点滴在试纸的中部,待试纸变色后,再与标准比色卡比较来确定溶液的pH值,
故答案为:溶液中过量的氢氧根离子和碳酸根离子;取少量的PH试纸置于玻璃片上,用蘸有待测溶液的玻璃棒点滴在试纸的中部,待试纸变色后,再与标准比色卡比较来确定溶液的pH值;
(5)从溶液中制取晶体的方法是蒸发结晶,所用的瓷质仪器名称是蒸发皿,故答案为:蒸发皿.
分析:(1)向工业废水中加试剂a能发生氧化还原反应且不引进新的杂质,且试剂a有氧化性,据此判断a;萃取剂必须具备的条件是:溶质在萃取剂中的溶解度大于在水中的溶解度,且和水不互溶,据此判断;
(2)根据分离物质的状态判断其名称;
(3)根据实验目的选择试剂除去杂质离子,本实验是制取氯化钾,所以除杂的试剂应选含有钾离子或氯离子的物质,注意先后顺序;
(4)为除去溶液中的Ca2+、Mg2+、SO4-2离子,所选取的试剂应滴加过量,调节溶液的PH值为除去溶液中过量的杂质离子;根据pH值的测定方法测定;
(5)由溶液制得晶体需要加热蒸发,所需瓷质仪器名称是蒸发皿.
点评:本题考查了物质的分离和提纯的方法,难度不大,注意除杂的原则是除去杂质且不引进新的杂质.
故答案为:H2O2;CCl4;
(2)分离两种不相溶的液体的操作是分液,所以操作①是分液;分离两种互溶的液体采用蒸馏的方法,所以操作②是蒸馏;分离不溶性的固体和液体的方法是过滤,所以操作③是过滤;从溶液中制得晶体的方法是蒸发结晶,故操作④是蒸发结晶,
故答案为:b;
(3)本实验是制取氯化钾,所以除杂的试剂应选含有钾离子或氯离子的物质,所以除去钙离子应选用碳酸钾溶液,除去镁离子应选氢氧化钾溶液,除去硫酸根离子应选用氯化钡溶液;应先除去硫酸根离子,多余的钡离子用碳酸根离子除去,所以先滴加氯化钡溶液;然后滴加碳酸钾溶液,除去溶液中的钙离子和钡离子;最后加氢氧化钾溶液,除去溶液中的镁离子,多余的氢氧根离子和碳酸根离子用调节溶液PH值的方法除去,
故答案为:BaCl2、K2CO3、KOH;
(4)除去溶液中的钙离子和镁离子后,溶液中有过量的氢氧根离子和碳酸根离子,它们属于杂质离子,应除去,所以调节溶液的PH值以除去溶液中过量的氢氧根离子和碳酸根离子.
测定溶液PH值的方法是:取少量的PH试纸置于玻璃片上,用蘸有待测溶液的玻璃棒点滴在试纸的中部,待试纸变色后,再与标准比色卡比较来确定溶液的pH值,
故答案为:溶液中过量的氢氧根离子和碳酸根离子;取少量的PH试纸置于玻璃片上,用蘸有待测溶液的玻璃棒点滴在试纸的中部,待试纸变色后,再与标准比色卡比较来确定溶液的pH值;
(5)从溶液中制取晶体的方法是蒸发结晶,所用的瓷质仪器名称是蒸发皿,故答案为:蒸发皿.
分析:(1)向工业废水中加试剂a能发生氧化还原反应且不引进新的杂质,且试剂a有氧化性,据此判断a;萃取剂必须具备的条件是:溶质在萃取剂中的溶解度大于在水中的溶解度,且和水不互溶,据此判断;
(2)根据分离物质的状态判断其名称;
(3)根据实验目的选择试剂除去杂质离子,本实验是制取氯化钾,所以除杂的试剂应选含有钾离子或氯离子的物质,注意先后顺序;
(4)为除去溶液中的Ca2+、Mg2+、SO4-2离子,所选取的试剂应滴加过量,调节溶液的PH值为除去溶液中过量的杂质离子;根据pH值的测定方法测定;
(5)由溶液制得晶体需要加热蒸发,所需瓷质仪器名称是蒸发皿.
点评:本题考查了物质的分离和提纯的方法,难度不大,注意除杂的原则是除去杂质且不引进新的杂质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目