题目内容
“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
(1)将空气液化后蒸馏分离出氧气,获得氮气 过滤 (2)N2+3H2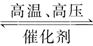 2NH3
2NH3
(3)CaSO4+CO2+2NH3+H2O=CaCO3↓+2NH+SO
(4)用湿润的红色石蕊试纸放在导气管口,若试纸变蓝,则证明有NH3(或其他可行的方法)
(5)CaO CO2
解析

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案下列叙述中,不符合化学史事实的是( )
| A.法国化学家拉瓦锡建立燃烧现象的氧化学说使近代化学取得了革命性进展 |
| B.英国化学家在世界上首次合成了具有生物活性的蛋白质-------牛胰岛素 |
| C.以碳及其化合物为原料制成的芯片和光导纤维引领我们进入了信息时代 |
| D.经过化学家们的不断努力,从自然界中发现以及人工制造出的化合物已经超过3500万种 |
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)
 CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。 


 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。