题目内容
【题目】研究表明氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。下列叙述正确的是

A. 图中涉及的物质都是电解质
B. SO2→SO3的过程是吸热过程
C. 图中涉及的无机化合物在一定条件下均具有氧化性
D. 理论上图中氧化物和水的反应都能设计成原电池
【答案】C
【解析】
A. 电解质包括酸碱盐和部分氧化物,大部分非金属氧化物如SO2、SO3及氮的氧化物都是非电解质,故A错误; B. SO2→SO3是放热反应,故B错误;C. 图中所示的物质含有的元素中,至少有一种元素的化合价可以降低,所以具有氧化性,故C项正确;D. 原电池的反应原理是能自发进行的氧化还原反应,上图中SO3+ H2O = H2SO4,不属于氧化还原反应,不能设计成原电池,故D错误;答案:C。

【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。请回答下列问题:
(1)已知:H2的燃烧热△H为-285.8kJ/mol。
N2(g)+2O2(g)=2NO2(g) △H=+133 kJ/mol
H2O(g)=H2O(1) △H=-44 kJ/mol
则H2和NO2反应生成两种无污染的气体的热化学反应方程式为______________________。
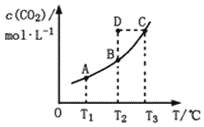
(2)一定温度下,向2L恒容密闭容器中充入0.40molN2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①0~40s内,v(NO2)=___________。
②升高温度时,气体颜色加深,则上述反应是___________(填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数K=___________。
④相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后c(NO2)___________(填“>”=”或”<”)0.60mol/L
(3)已知2NO(g)+O2(g)![]() 2NO2(g) △H的反应历程分两步:
2NO2(g) △H的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) △H2<O,v2正=k2正c (N2O2)·c(O2),v2逆=k2逆c 2(NO2)
2NO2(g)(慢) △H2<O,v2正=k2正c (N2O2)·c(O2),v2逆=k2逆c 2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1___________E2(填“>”“<”或“=”),其判断理由是____________________;2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正/span>、k2逆的关系式为______________________。
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正/span>、k2逆的关系式为______________________。
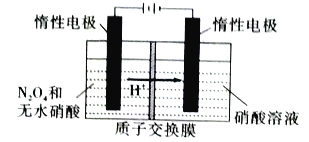
(4)N2O5是绿色硝化试剂,溶于水可得硝酸。下图是以N2O4为原料电解制备N2O的装置。写出阳极区生成N2O5的电极反应式(注意阳极区为无水环境,HNO3亦无法电离): _________________________________。
【题目】I.(1)三种弱酸HA、H2B、HC,电离平衡常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
① HA + HB- (少量)=A-+ H2B,② H2B(少量) + C-=HB-+ HC,③ HA(少量) + C-=A-+ HC 。
则三种酸对应的电离平衡常数分别为(请在下面填空):________
HA | H2B | HC | ||
Ka | Ka1 | Ka2 | Ka3 | Ka4 |
数值 | ||||
(2)常温下0.1 mol/L CH3COOH溶液加水稀释过程,下列表达式数据一定变小是________。
A.c(H+) B.n(H+) C. c(CH3COO-)/ c(H+) D.c(CH3COOH)/c(H+)
II.工业废水中常含有一定量的Cr2O72- 和CrO42-,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。

(1)转化过程中存在平衡2CrO42- + 2H+![]() Cr2O72- + H2O能说明反应到达平衡状态的是____。
Cr2O72- + H2O能说明反应到达平衡状态的是____。
A.CrO42-和Cr2O72-的浓度相同 B.ν正(Cr2O72-)=2 ν逆(CrO42-)
C.溶液的pH值保持不变 D.溶液颜色保持不变
(2)若1 L转化后所得溶液中含铬元素质量为28.6 g,CrO42- 有10/11转化为Cr2O72-(已知铬元素相对原子质量为52)。
① 转化后所得溶液中c(Cr2O72-)=_________________。
② 已知:常温下该反应的平衡常数K=1014,上述溶液转化后H+的物质的量浓度为_________。