题目内容
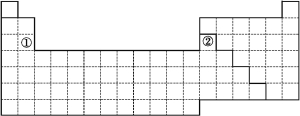
【题目】下图是元素周期表的简略框架图。

(1)请在上图所示的元素周期表中画出金属元素与非金属元素的分界线。按电子排布,可把元素划分成5个区,不全是金属元素的区为 。
(2)根据氢元素最高正化合价与最低负化合价的绝对值相等,你认为还可把氢元素放在元素周期表中的第 族;有人建议将氢元素排在元素周期表的第ⅦA族,请你写出支持这一观点的一个化学事实: 。
(3)上图中元素①②原子的价电子排布式分别为 、 。
比较元素①与元素②的下列性质(填“>”或“<”)。
原子半径:① ②;电负性:① ②;
金属性:① ②;第一电离能:① ②。
(4)某短周期元素最高正化合价为+7,其原子结构示意图为 。
【答案】(1)
s区和p区
(2)ⅣA 氢原子得到一个电子达到最外层2电子的稳定结构(其他合理答案如与碱金属元素一样可形成离子化合物M+[∶H]-或NaH的存在等均可)(3)3s2 3s23p1 > < > > (4) +17
【解析】(1)金属元素与非金属元素的分界线是非金属元素的硼、硅、砷、碲、砹与金属元素铝、锗、锑、钋之间的分界线,按电子填充顺序把元素周期表划分为5个区,即s区、p区、d区、ds区和f区,其中s区中的氢以及p区的大部分元素不是金属元素。
(2)最高正化合价与最低负化合价绝对值相等的族为第ⅣA族;氢原子得到1个电子达到稳定结构,这一特点同第ⅦA族元素相同。
(3)由①和②在元素周期表中的位置可以确定①和②分别为Mg和Al,价电子排布式分别为3s2和3s23p1。利用同周期元素的递变规律可知,原子半径:Mg>Al,金属性:Mg>Al,电负性:Al>Mg;第ⅡA族元素的第一电离能比同周期相邻元素的第一电离能大,所以第一电离能:Mg>Al。
(4)短周期元素最高正化合价为+7的元素应为第ⅦA族元素,氟元素无正价,所以该元素为氯元素。

 阅读快车系列答案
阅读快车系列答案


