题目内容
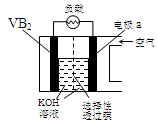
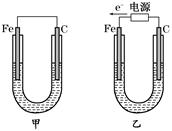
如图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线上均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述中正确的是


| A.产生气体的体积:(1)> (2) |
| B.电极上析出物质的质量:(1)> (2) |
| C.溶液pH的变化:(1)增大,(2)减小 |
| D.电极反应式:(1)中阳极:4OH--4e-===2H2O+O2↑,(2)中负极:2H++2e-===H2↑ |
B
试题分析:A、(1)为电解池,阳极生成氧气;(2)是原电池,正极产生氢气,当线上均通过0.02 mol电子时产生的气体氢气是氧气的2倍,所以(2)>(1),错误;B、电解池中有0.01mol的铜析出,原电池中没有物质析出,所以电极上析出物质的质量:(1)> (2),正确;C、电解池中氢氧根离子放电,导致溶液中的氢离子浓度增大,pH减小,原电池中氢离子放电,导致溶液氢离子浓度减小,pH增大,错误;D、(2)中的负极是锌失电子成为锌离子,Zn-2e-===Zn2+,错误,答案选B。

练习册系列答案
相关题目
 Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0