题目内容
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为
A.22.1 g B.27.2 g C.30 g D.无法计算
【答案】
B
【解析】
试题分析:合金先和硝酸反应,失去电子变为离子,然后三种金属离子又和NaOH反应全部变为沉淀,所以总的来看,沉淀的质量就是金属的质量加上所得的OH—的质量,而金属所得的OH—的物质的量与失去的电子的物质的量相等。金属失去的电子全部转移给了N得到NO,故n(OH—)=n(e—)=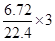 mol=0.9mol,所得沉淀的质量为11.9+17×0.9=27.2g。
mol=0.9mol,所得沉淀的质量为11.9+17×0.9=27.2g。
考点:考查化学计算技巧和方法,氧化还原反应规律。

练习册系列答案
相关题目
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为( )
| A.22.1 g | B.27.2 g | C.30 g | D.无法计算 |