题目内容
硅孔雀石是一种含铜的矿石,含铜形态为
 ,同时含有
,同时含有 等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:
等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:
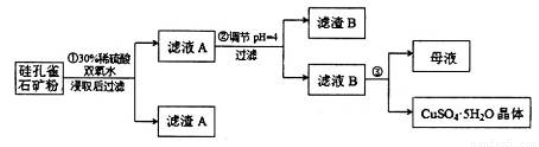
请回答下列问题:
(1)完成步骤①中稀硫酸与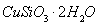 发生反应的化学方程式
发生反应的化学方程式
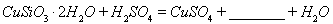 ;
;
用离子方程式表示双氧水的作用_____________________________。
(2)步骤②调节溶液pH选用的最佳试剂是__________________
A. ????????????? ????????????? ? B.CuO????????????? ????????????? ??? C.A12O3????????????? ????????????? ????? D.
????????????? ????????????? ? B.CuO????????????? ????????????? ??? C.A12O3????????????? ????????????? ????? D.
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:

由上表可知:当溶液pH=4时,可以完全除去的离子是______,不能完全除去的离子是________。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到 晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,
晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,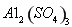 饱和溶液中
饱和溶液中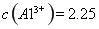 mol
mol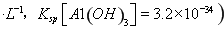 ______________。
______________。
(5)若要测定硫酸铜晶体中结晶水的含量,需要的仪器是酒精灯、托盘天平、三角架、泥三角、玻璃棒、干燥器、坩埚钳、研钵、药匙、_________________。实验过程中硫酸铜晶体加热失水后在空中冷却后称量,则测定结果______________(填“偏高”、? “偏低”或“不变”)。???
(1)H4SiO4(1分) 2Fe2++H2O2+2H+= 2Fe3++2H2O(2分)
(2)B(2分)
(3)Fe3+(2分),Al3+(2分)
(4)该同学的观点是错误的(1分)通过计算可知,滤液B中C(Al3+)=3.2×10-4 mol?L-1,浓缩后C(Al3+)=6.4×10-4 mol?L-1《2.25 mol?L-1,所以不会有硫酸铝晶体洗出。(2分)
(5)坩埚(1分) 偏低(1分)
【解析】
试题分析:(1)根据原子守恒可知缺H4SiO4,孔雀石酸溶后有Fe2+,双氧水有强氧化性,发生氧化还原反应: 2Fe2++H2O2+2H+= 2Fe3++2H2O;(2)调节pH=4的目的是沉淀Fe3+,最后得到硫酸铜晶体,为不引入杂质,选择B;(3)结合表中所给数据分析;(4)该同学的观点是错误的,通过计算可知,滤液B中C(Al3+)=3.2×10-4 mol?L-1,浓缩后C(Al3+)=6.4×10-4 mol?L-1《2.25 mol?L-1,所以不会有硫酸铝晶体洗出;(5)坩埚, 硫酸铜在空气中中冷却后吸收了部分水,导致质量增大,测得结晶水含量偏低。
考点:考查化学与生产工艺、定量分析。
