题目内容
【题目】目前,我国使用的能源主要是煤、石油、天然气等,这些能源都是不可再生且污染环境的能源,研究和开发清洁而又用之不竭的能源是未来发展的首要任务。科学家预测氢能将是21世纪最理想的新能源之一。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发又较经济且资源可持续利用的制氢气的方法是________(填序号)。
A.电解水 B.锌和稀硫酸反应 C.光解海水
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:![]()
![]()
![]()
![]()
由甲烷制氢气的一个缺点是________。
(3)将![]() 进行热分解也可以制得氢气
进行热分解也可以制得氢气![]()
![]() 。热分解制氢气时,常向反应器中通入一定比例的空气,使部分
。热分解制氢气时,常向反应器中通入一定比例的空气,使部分![]() 燃烧,其目的是_________________________。
燃烧,其目的是_________________________。
(4)镁铝合金(![]() )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的
)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的![]() 、
、![]() 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为![]() 得到的混合物
得到的混合物![]() 在一定条件下可释放出氢气。
在一定条件下可释放出氢气。
①熔炼制备镁铝合金(![]() )时通入氩气的目的是____________________________________。
)时通入氩气的目的是____________________________________。
②在足量的![]() 的
的![]() 溶液中,混合物Y能完全释放出
溶液中,混合物Y能完全释放出![]() 。
。![]()
![]() 完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出
完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出![]() 的物质的量为________。
的物质的量为________。
【答案】C 需要消耗大量能量(其他合理答案也可) 为H2S的热分解反应提供热量 防止Mg、Al被空气氧化 52mol
【解析】
1molMg17Al12可得到17molMgH2和12molAl,加入足量HCl,一方面Mg和Al与HCl反应放出氢气,另一方面,Mg和Al溶解,储存的氢气释放出来。
(1) A.电解水消耗大量的电能,不经济,A错误;
B.锌和稀硫酸反应消耗大量的Zn和硫酸,不经济,B错误;
C.太阳能和海水取之不尽,经济且可持续,C正确;
故答案为:C;
(2)两个反应都是吸热反应,需要消耗大量的能量,故答案为:需要消耗大量能量(其他合理答案也可);
(3)H2S分解产生H2的反应是吸热反应,部分H2S燃烧可产生热量,提供给H2S分解,故答案为:为H2S的热分解反应提供热量;
(4)①氩气是稀有气体,化学性质不活泼,可以防止Mg、Al在熔化过程中被氧气氧化,故答案为:防止Mg、Al被空气氧化;
②1molMg17Al12可得到17molMgH2和12molAl,加入足量HCl,一方面Mg和Al与HCl反应放出氢气,另一方面,Mg和Al溶解,储存的氢气释放出来。由Mg~H2可知,1molMg产生1molH2,17molMg产生17molH2,17molMgH2产生17mol+17mol=34molH2,由2Al~3H2可知,1molAl可产生1.5molH2,所以12molAl可产生12mol×1.5=18molH2,故1molMg17Al12完全吸氢后的Y与HCl反应共放出34mol+18mol=52molH2,故答案为:52mol。

【题目】锰的合金及其化合物在现代生产、生活中有着广泛的应用。如二氧化锰是重要的氧化剂、催化剂、干电池中的去极剂;硫酸锰是重要的微量元素肥料。
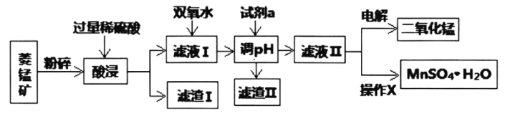
Ⅰ.某工厂以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料联合生产二氧化锰、硫酸锰晶体的工艺流程如下图所示:
常温下几种金属氧化物沉淀时的pH:
Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时的pH | 7.2 | 2.7 | 4.7 |
完全沉淀时的pH | x | 3.7 | 6.7 |
(1)该工厂调pH时,选择试剂a的成分最好是________,滤渣Ⅱ的成分是________,操作X是________、洗涤、低温烘干。
(2)为确保除尽杂质而又不损失锰,pH调整的范围为________;若常温下离子(X)沉淀完全的标准是c(X)<1.0×10-5mol/L,Ksp[Mn(OH)2]=1.0×10-13,则使Mn2+完全沉淀时溶液的pH最小为________。
(3)若滤液Ⅱ显酸性,请写出电解法制备MnO2时阳极上的电极反应式:________。
Ⅱ.50.7g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化曲线)如下图所示。(已知:M(Mn)=55g/mol)
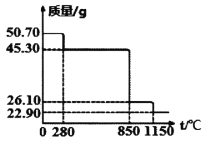
(1)850℃时,所得固体的化学式为:________________________。
(2)1150℃时,反应的化学方程式为:________________________。