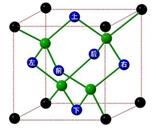
题目内容
下列有关金属的说法正确的是
| A.金属原子的核外电子在金属晶体中都是自由电子 |
| B.已知金属钠的晶体堆积模型是体心立方堆积,则其配位数是6 |
| C.已知金属镁的晶体堆积模型是六方最密堆积,则其配位数是12 |
| D.金属导电的实质是金属阳离子在外电场作用下的定向移动 |
C
解析试题分析:A选项,金属原子的核外电子在金属晶体中,最外层电子肯定是自由电子,内层电子受到核内质子的吸引,而不自由,故A错误。B选项,面心立方堆积如果是金属原子,则其配位数是12,因为周围的原子都与该原子形成金属键的,故B错误, D选项,金属导电的实质是金属内部有自由移动的电子形成定向移动,故D错误.所以答案选C
考点:考查金属性质的相关知识点。

硫元素可以形成多种物质如 、SO2、SO32-、SO42-等。
、SO2、SO32-、SO42-等。
(1) 中S原子的轨道杂化类型是 ,
中S原子的轨道杂化类型是 , 的空间构型是 。
的空间构型是 。
(2)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。分析表明该沉淀中Cu、S、N的物质的量之比为1:1:1,经测定该沉淀的晶体里有一种三角锥型的阴离子和一种正四面体型的阳离子。
①[Cu(NH3)4]SO4中Cu2+的电子排布式为 。
②[Cu(NH3)4]SO4中存在的化学键类型有 (填序号)。
| A.共价键 | B.氢键 | C.离子键 | D.配位键 E.分子间作用力 |
(18分)水是组成生命体的重要化学物质,有关水的反应有很多。
(1)水分子的空间构型为___________;水分子自身作用会生成阴、阳两种离子,其中阴离子的电子式是___________
(2)如图是某品牌饮用矿泉水标签的部分内容。请计算一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过___________。
(3)标况下将a L氨气溶于1L水中,得到的溶液密度为b g·cm﹣3。用化学方程式表示氨气溶于水显碱性的原因___________该溶液的物质的量浓度为___________mol·L﹣1。
(4)已知M是生活中常见的一种金属,将44.8 g M完全溶于很稀的过量硝酸,向所得溶液中加入足量固体烧碱并加热,放出6.72 L(标准状况)气体。M溶于该很稀的硝酸的离子方程式为___________________。M与水在高温条件下,生成1g气体吸热a kJ,写出该反应的热化学方程式_________________________________。
(5)味精是常用的调味品,当前味精生产主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
①淀粉发生水解反应的化学方程式是_________________________________
②实验室中检验淀粉水解产物应选用的试剂可以是___________ (填字母)·
| A.NaOH溶液、氨水、AgNO3溶液 | B.H2SO4溶液、氨水、AgNO3溶液 |
| C.NaOH溶液、CuSO4溶液 | D.H2SO4溶液、CuSO4溶液 |
下列物质的晶体属于分子晶体的是
| A.Si | B.CO2 | C.NaCl | D.Cu |
下列关于晶体的叙述错误的是( )
| A.在金刚石网状结构中,由共价键形成的最小碳环上有6个碳原子 |
| B.在氯化钠晶体中,每个钠离子的周围与它最近且等距离的钠离子有12个 |
| C.在干冰晶体中,每个二氧化碳分子周围距离最近且相等的二氧化碳分子数是12 |
| D.在氯化铯的晶体中,每个铯离子的周围与它最近且等距离的铯离子有8个 |
KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O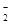 代替,则下列对于KO2晶体结构的描述正确的是
代替,则下列对于KO2晶体结构的描述正确的是
A.与K+距离相等且最近的O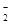 共有8个 共有8个 |
B.与K+距离相等且最近的O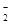 构成的多面体是正八面体 构成的多面体是正八面体 |
| C.与K+距离相等且最近的K+有8个 |
D.一个KO2晶胞中的K+和O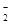 粒子数均为8个 粒子数均为8个 |
下列有关分子晶体熔点的高低叙述中,正确的是( )。
| A.Cl2>I2 | B.SiCl4>CCl4 |
| C.N2>O2 | D.C(CH3)4>CH3CH2CH2CH2CH3 |