题目内容
下列各项叙述中,不正确的是( )A.氯化氢是纯净物,盐酸是混合物
B.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2mol电子
C.0.012kg12C所含的原子数能表示阿伏加德罗常数的数值
D.16gCH4与18gNH4+所含质子数相等
B、反应中氧元素被氧化,化合价由-1价升高为0价,根据n=
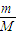 计算氧气的物质的量,计算电子物质的量.
计算氧气的物质的量,计算电子物质的量.C、0.012kg12C所含的碳原子数为阿伏加德罗常数的数值.
D、CH4分子含有10个质子,NH4+含11个,结合物质的量判断.
解答:解:A、氯化氢只含HCl分子属于纯净物,盐酸是氯化氢的水溶液属于混合物,故A正确;
B、反应中氧元素被氧化,化合价由-1价升高为0价,生成32g氧气,则转移2电子的物质的量为
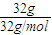 ×2=2mol,故B正确;
×2=2mol,故B正确;C、0.012kg12C所含的碳原子数为阿伏加德罗常数的数值,故C正确;
D、CH4分子含有10个质子,NH4+含11个,16gCH4与18gNH4+的物质的量都为1mol,所含质子数不相等,故D错误.
故选:D.
点评:考查常用化学计量的有关计算、阿伏加德罗常数、混合物与纯净物辨析,难度不大,注意B中过氧化氢中氧元素的化合价为-1价.

 名校课堂系列答案
名校课堂系列答案A、B、C、D是短周期元素形成的四种气体单质,其它物质为化合物。H常作为普通锌锰干电池的电解质。有关的转化关系如下图所示(反应条件均已略去)。
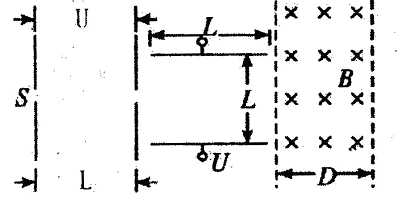
请回答下列问题:
(1)B的结构式为____ ,G的化学式为 。
(2)Y和E在一定条件下可反应生成B和Z,该反应的化学方程式为 。
(3)在体积为0.5L的恒容密闭容器中,充人1.25molB和1.25molD进行如下化学反应:
B(g)+3D(g) 2Y(g),其化学平衡常数K与T的关系如下表所示:
2Y(g),其化学平衡常数K与T的关系如下表所示:
|
T/℃ |
300 |
400 |
|
K |
3.41 |
0.50 |
①若反应在400℃下进行,下列各项中能作为判断该反应达到化学平衡状态依据的是
(填字母)。
A.Y、B、D的物质的量分别为0.50mol、l.0mol、0.50mol
B.v正(B)= 3v 逆(D)
C.容器内压强保持不变
D.混合气体的密度保持不变
②在一定条件下B(g)+3D(g)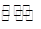 2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
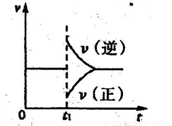
A.维持温度、反应体系体积不变,t1时充入Y(g)
B.维持压强不变,tl时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入Y(g)
(4)0.lmol·L-1的X溶液和0.2mol·L-1的Y溶液等体积混合后显碱性,则该混合溶液中各离子浓度大小顺序是 .
(5)常温下,0.1mol·L-1的Y溶液中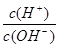 =l×10-8,下列叙述中错误的是 ( )
=l×10-8,下列叙述中错误的是 ( )
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度为0.1mol·L-1
C.该溶液中水电离出的c(H+)与c(OH—)乘积为l×10-22
D.pH=l的X溶液V1L与0.1mol·L-1的Y溶液V2L混合,若混合溶液pH =7,则V1<V2
E.将0.1mol·L-1的Y溶液加水稀释100倍后,pH >9
氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)
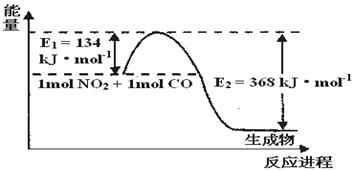
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
![]() N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1.K2的大小,K1_ K2(填写“>”.“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_ ___(填序号字母):
a.容器内N2.H2.NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时, 当测得NH3和N2.H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正_ _ v(N2)逆(填写“>”.“=”或“<”)
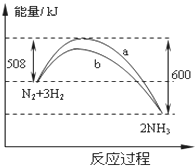 (3)一定条件下,在体积为VL的密闭容器中进行反应:
(3)一定条件下,在体积为VL的密闭容器中进行反应:![]()
![]()
![]() ,其n(H2)和n(NH3)随时间变化的关系如下图(左)所示。从开始到平衡时,反应的平均速率用H2的浓度变化表示为
,其n(H2)和n(NH3)随时间变化的关系如下图(左)所示。从开始到平衡时,反应的平均速率用H2的浓度变化表示为![]() 。
。
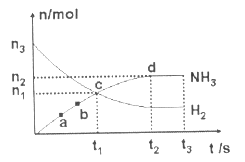
(4)在一定温度时,N2与H2反应过程中能量变化的曲线如第5页下方右图所示,下列叙述正确的是( )
A.逆反应的活化能不小于92kJ/mol B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应放热增多 D.加入催化剂可增大正反应速率,降低逆反应速率
A、B、C、D是短周期元素形成的四种气体单质,其它物质为化合物。H常作为普通锌锰干电池的电解质。有关的转化关系如下图所示(反应条件均已略去)。
请回答下列问题:
(1)B的结构式为____ ,G的化学式为 。
(2)Y和E在一定条件下可反应生成B和Z,该反应的化学方程式为 。
(3)在体积为0.5L的恒容密闭容器中,充人1.25molB和1.25molD进行如下化学反应:
B(g)+3D(g)2Y(g),其化学平衡常数K与T的关系如下表所示:
| T/℃ | 300 | 400 |
| K | 3.41 | 0.50 |
①若反应在400℃下进行,下列各项中能作为判断该反应达到化学平衡状态依据的是
(填字母)。
A.Y、B、D的物质的量分别为0.50mol、l.0mol、0.50mol
B.v正(B)= 3v 逆(D)
C.容器内压强保持不变
D.混合气体的密度保持不变
②在一定条件下B(g)+3D(g)2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
A.维持温度、反应体系体积不变,t1时充入Y(g)
B.维持压强不变,tl时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入Y(g)
(4)0.lmol·L-1的X溶液和0.2mol·L-1的Y溶液等体积混合后显碱性,则该混合溶液中各离子浓度大小顺序是 .
(5)常温下,0.1mol·L-1的Y溶液中=l×10-8,下列叙述中错误的是 ( )
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度为0.1mol·L-1
C.该溶液中水电离出的c(H+)与c(OH—)乘积为l×10-22
D.pH=l的X溶液V1L与0.1mol·L-1的Y溶液V2L混合,若混合溶液pH =7,则V1<V2
E.将0.1mol·L-1的Y溶液加水稀释100倍后,pH >9
 2Y(g),其化学平衡常数K与T的关系如下表所示:
2Y(g),其化学平衡常数K与T的关系如下表所示: 1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )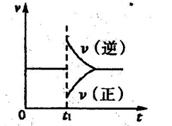
 =l×10-8,下列叙述中错误的是 ( )
=l×10-8,下列叙述中错误的是 ( )