题目内容
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现甲同学的实验中,褪色的溶液里有少许的淡黄色浑浊,推测在制得的乙炔中可能还含有少量的还原性杂质气体,由此他提出必须先将其除去,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要反应的化学方程式__________________.
(2)甲同学设计的实验________。(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是________。(多选扣分).
A.使溴水褪色的反应,未必是加成反应 B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙炔 D.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有一种杂质气体是________,它与溴水反应的化学方程式________________;验证过程中必须全部除去。
(4)如果选用下列编号为A、B、C、D的四种装置(可以重复使用)来实现乙同学的实验方案。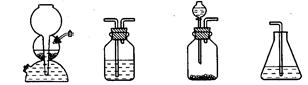
A B C D
请你写出所选择的装置编号及装置中的化学药品名称填在方格内或括号内
(电石、水) ( ) ( )( )
(1)(各2分)

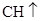
CH
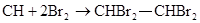 (2)(各2分)不能 A、C
(2)(各2分)不能 A、C
(3)(各2分)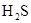



(4)(4分)C(电石、水) B(硝酸铅溶液)
B(硝酸铅溶液) B(硝酸铅溶液)
B(硝酸铅溶液) D(溴水)
D(溴水)
解析试题分析:(1)电石与水反应生成乙炔,乙炔和溴水发生加成反应,有关反应的化学方程式分别是

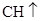 、CH
、CH
 。
。
(2)由于使溴水褪色的反应,不一定是加成反应,且能使溴水褪色的物质也不一定是乙炔,所以甲同学的结论是错误的,答案选AC。
(3)根据褪色的溶液里有少许的淡黄色浑浊,这说明该淡黄色物质应该是单质S,所以乙炔中必定含有一种杂质气体是H2S。溴水具有还原性,能氧化H2S生成S单质,反应的方程式是

 。
。
(4)由于电石溶于水,极易粉碎,所以该实验不能选择启普发生器,应该选择C装置。由于H2S能干扰乙炔的检验,所以需要先除去H2S,选择的试剂是硝酸铅。为了检验H2S是否完全被除尽,还需要再次通过硝酸铅溶液,最后通入溴水中检验乙炔。
考点:考查乙炔的制备、检验、物质的除杂、方程式的书写
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和实验方法指导与训练,有利于培养学生规范、严谨的实验设计、评价能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。

 智慧小复习系列答案
智慧小复习系列答案 或HC≡CH+2Br2→
或HC≡CH+2Br2→



 色的物质,就是乙炔
色的物质,就是乙炔
