题目内容
下列递变规律不正确的是( )
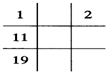
| A.O、S、Na、K原子半径依次增大 |
| B.Ca(OH)2、Mg(OH)2、KOH的碱性逐渐增 |
| C.HF、HCl、H2S、PH3稳定性依次减弱 |
| D.还原性强弱顺序F-<Cl-<I- |
A、电子层越多,原子半径越大,同周期从左向右原子半径在减小,O有2个电子层,S、Na有3个电子层,K有4个电子层,则O、S、Na、K原子半径依次增大,故A正确;
B、金属性K>Ca>Mg,对应最高价氧化物的水化物的碱性为KOH>Ca(OH)2>Mg(OH)2,故B错误;
C、非金属性F>Cl>S>P,则HF、HCl、H2S、PH3稳定性依次减弱,故C正确;
D、非金属性F>Cl>I,则对应离子的还原性强弱顺序F-<Cl-<I-,故D正确;
故选B.
B、金属性K>Ca>Mg,对应最高价氧化物的水化物的碱性为KOH>Ca(OH)2>Mg(OH)2,故B错误;
C、非金属性F>Cl>S>P,则HF、HCl、H2S、PH3稳定性依次减弱,故C正确;
D、非金属性F>Cl>I,则对应离子的还原性强弱顺序F-<Cl-<I-,故D正确;
故选B.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目