题目内容
 据新浪网报道:2010年8月19日在东川“味永佳”餐馆吃过晚饭的6个人,两天后却相继躺到了省红会医院的病床上,诊断均为甲醇中毒.甲醇是一种无色、透明、易燃、易挥发的有毒液体,略有酒精气味,误饮5~10毫升能双目失明,大量饮用会导致死亡.
据新浪网报道:2010年8月19日在东川“味永佳”餐馆吃过晚饭的6个人,两天后却相继躺到了省红会医院的病床上,诊断均为甲醇中毒.甲醇是一种无色、透明、易燃、易挥发的有毒液体,略有酒精气味,误饮5~10毫升能双目失明,大量饮用会导致死亡.(1)CH3OH是一种可燃性的液体.
已知:①CH3OH(g)+H2O(I)=CO2(g)+3H2(g);△H=+93.0kJ?mol-1
②CH3OH(g)+
| 1 |
| 2 |
③CH3OH(g)=CH3OH(I);△H=-38.19kJ?mol-1
则表示CH3OH的燃烧热的热化学方程式为
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l);△H=-726.51kJ?mol-1
| 3 |
| 2 |
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l);△H=-726.51kJ?mol-1
.| 3 |
| 2 |
(2)燃料电池是符合绿色化学理念的新型发电装置,CH3OH-空气燃料电池是一种碱性(20%~30%的KOH溶液)燃料电池.电池放电时,负极的电极反应式为
CH3OH-6e-+8OH-=CO32-+6H2O
CH3OH-6e-+8OH-=CO32-+6H2O
.(3)如图是一个电解过程示意图,假设使用CH3OH-空气燃料电池作为本过程中的电源,其中a为电解液,X和Y是两块电极板.
①若X和Y均为惰性电极,a为饱和食盐水,电解可制备“84”消毒液.通电时阳极产生的气体被溶液完全吸收,若所得消毒液仅含一种溶质,电解的总化学方程式是
NaCl+H2O
NaClO+H2↑
| ||
NaCl+H2O
NaClO+H2↑
.
| ||
②若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,Y极板上发生的电极反应式为
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
.③若X、Y分别为石墨和铜,a为CuSO4溶液,铜片的质量变化128g,则CH3OH-空气燃料电池理论上消耗标准状况下的空气
112
112
L(假设空气中氧气体积分数为20%).分析:(1)根据盖斯定律计算;
(2)负极上燃料失电子发生氧化反应;
(3)①用惰性电池电解氯化钠溶液,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气,氯气和氢氧化钠反应生成次氯酸钠和氯化钠,氯化钠又被循环利用;
②若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,Y极即阳极上氢氧根离子放电;
③根据转移电子相等计算需要空气的体积.
(2)负极上燃料失电子发生氧化反应;
(3)①用惰性电池电解氯化钠溶液,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气,氯气和氢氧化钠反应生成次氯酸钠和氯化钠,氯化钠又被循环利用;
②若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,Y极即阳极上氢氧根离子放电;
③根据转移电子相等计算需要空气的体积.
解答:解:(1)由②×3-①×2-③后再移项整理得,CH3OH (l)+
O2(g)=CO2(g)+2H2O(l);△H=-726.51 kJ?mol-1,
故答案为:CH3OH (l)+
O2(g)=CO2(g)+2H2O(l);△H=-726.51 kJ?mol-1;
(2)燃料电池中,负极上甲醇失电子发生氧化反应,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)①用惰性电池电解氯化钠溶液,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气,氯气和氢氧化钠反应生成次氯酸钠和氯化钠,氯化钠继续被电解,最终溶液中的溶质只有次氯酸钠,所以反应的生成物是次氯酸钠和氢气,则电池反应式为:NaCl+H2O
NaClO+H2↑,
故答案为:NaCl+H2O
NaClO+H2↑;
②若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,Y极即阳极上氢氧根离子放电生成氧气,所以Y极上电极反应式为:4OH--4e-=O2↑+2H2O,
故答案为:4OH--4e-=O2↑+2H2O;
③若X、Y分别为石墨和铜,a为CuSO4溶液,电解硫酸铜溶液时,铜电极上铜失电子发生氧化反应,当铜片的质量变化128g,失去电子的物质的量=
×2=4mol,
1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=
=112L,
故答案为:112.
| 3 |
| 2 |
故答案为:CH3OH (l)+
| 3 |
| 2 |
(2)燃料电池中,负极上甲醇失电子发生氧化反应,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)①用惰性电池电解氯化钠溶液,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气,氯气和氢氧化钠反应生成次氯酸钠和氯化钠,氯化钠继续被电解,最终溶液中的溶质只有次氯酸钠,所以反应的生成物是次氯酸钠和氢气,则电池反应式为:NaCl+H2O
| ||
故答案为:NaCl+H2O
| ||
②若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,Y极即阳极上氢氧根离子放电生成氧气,所以Y极上电极反应式为:4OH--4e-=O2↑+2H2O,
故答案为:4OH--4e-=O2↑+2H2O;
③若X、Y分别为石墨和铜,a为CuSO4溶液,电解硫酸铜溶液时,铜电极上铜失电子发生氧化反应,当铜片的质量变化128g,失去电子的物质的量=
| 128g |
| 64g/mol |
1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=
| ||
| 20% |
故答案为:112.
点评:本题考查了盖斯定律、原电池和电解池原理,明确原电池和电解池中放电顺序及串联电路中转移电子数相等即可解答,难度中等.

练习册系列答案
相关题目
据新浪网报道,欧洲一集团公司拟在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:2H2O
2H2↑+O2↑.有下列几种说法:①水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③使用氢气作燃料有助于控制温室效应;④氢气是一级能源.其中叙述正确的是( )
| ||
| 激光 |
| A、①② | B、③④ |
| C、②③ | D、①②③④ |
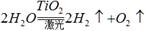 。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是
。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是 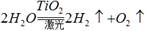 。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是
。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是  2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ?mol-1
2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ?mol-1