题目内容
由于水是一种很好的__________,水中的__________种类繁多,其危害也是多方面的,不仅会加剧__________,而且严重危害__________。据世界卫生组织报道,全世界__________左右的疾病与__________有关。水体污染还会对水中__________、__________、__________和__________生产等产生很大影响。溶剂 污染物 水资源短缺 人体健康 75% 水体污染 生态系统 工业 农业 渔业

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 CH3OH(g);△H=-90.7 kJ/mol;
CH3OH(g);△H=-90.7 kJ/mol;  CO2(g)+H2(g);△H=-41.2kJ/mol。
CO2(g)+H2(g);△H=-41.2kJ/mol。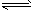 CH3OCH3(g) +CO2(g),则该反应的△H=____________
CH3OCH3(g) +CO2(g),则该反应的△H=____________ 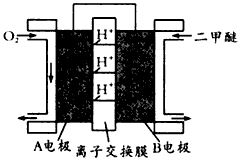
 SiHCl3(l)+ H2(g);
SiHCl3(l)+ H2(g); Si(纯) +3HCl。
Si(纯) +3HCl。