��Ŀ����
����Ŀ����14����Ϊȷ��ij���ȼ�����������Fe2O3����������ɣ��ֱ��������ʵ�顣
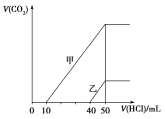
��1����ȡa g��Ʒ�������м���������NaOH��Һ��������ɵ��������Ϊ6.72L����״��������Ӧ�����ӷ���ʽ��________ _____ ����Ʒ������������____ ___g��
��2������ȡa g��Ʒ���������ȼ��ǡ����ȫ��Ӧ���÷�Ӧ�Ļ�ѧ����ʽ��________________����aΪ________________ g��
��3������2���з�Ӧ������ȴ�����������ᣬ��Ӧ�����ӷ���ʽΪ ��
��ͬʱ���ɵ������ڱ�״�����Ϊ L��
���𰸡���1��2Al +2OH- +2H2O=2AlO2- +3H2���� 5.4
��2��2Al +Fe2O3![]() Al2O3 +2Fe�� 21.4
Al2O3 +2Fe�� 21.4
��3��Fe+ 2H+=Fe2+ + H2����Al2O3 + 6H+=2Al3+ +3 H2O�� 4.48
��������
�����������1�����ȼ��ǽ��������������Ļ������������Ժ���������֮�䷴Ӧ����ƫ�����ƺ���������2Al+2NaOH+2H2O=2NaAlO2+3H2�������ӷ���ʽΪ��2Al+2OH-+2H2O=2AlO2-+3H2�������ݷ���ʽ��2Al+2NaOH+2H2O=2NaAlO2+3H2���������ɵ���������״������ͬ�����Ϊ6.72Lʱ���������������ʵ���Ϊ��![]() =0.3mol������Ʒ��Al������Ϊ��0.3mol����27g/mol=5.4g��
=0.3mol������Ʒ��Al������Ϊ��0.3mol����27g/mol=5.4g��
��2��������������Ӧ�ķ���ʽΪ��2Al+Fe2O3![]() Al2O3+2Fe������ǡ����ȫ��Ӧ�������������ʵ�����0.3mol��=0.2mol���������������ʵ���Ϊ��0.2mol��=0.1mol������Ϊ��160g/mol��0.1mol=16g����������������������Ϊ��5.4g+16g=21.4g��
Al2O3+2Fe������ǡ����ȫ��Ӧ�������������ʵ�����0.3mol��=0.2mol���������������ʵ���Ϊ��0.2mol��=0.1mol������Ϊ��160g/mol��0.1mol=16g����������������������Ϊ��5.4g+16g=21.4g��
��3���������ʵ�����0.3mol��=0.2mol�����ݷ�Ӧ2Al+Fe2O3![]() Al2O3+2Fe��֪��Ӧ�����������ʵ�����0.2mol�����������������ᷴӦ�����ӷ���ʽΪ��Fe+2H+=Fe2++H2����Al2O3+6H+=2Al3++3H2O��0.2mol����ȫ��Ӧ�������������ʵ���Ϊ0.2mol����״����0.2mol���������Ϊ��22.4L/mol��0.2mol=4.48L��
Al2O3+2Fe��֪��Ӧ�����������ʵ�����0.2mol�����������������ᷴӦ�����ӷ���ʽΪ��Fe+2H+=Fe2++H2����Al2O3+6H+=2Al3++3H2O��0.2mol����ȫ��Ӧ�������������ʵ���Ϊ0.2mol����״����0.2mol���������Ϊ��22.4L/mol��0.2mol=4.48L��

 Ŀ�����ϵ�д�
Ŀ�����ϵ�д�����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ���˾���װ���������ô�װ���ͱ����ṩ������������ʵ�飬�������ѡ������ ��
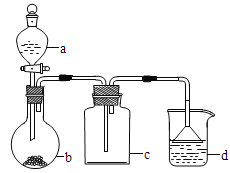
ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
A | �Ȼ��� | NaOH | NH3 | H2O |
B | Ũ���� | MnO2 | Cl2 | NaOH��Һ |
C | ϡ���� | Cu | NO2 | H2O |
D | Ũ���� | Na2SO3 | SO2 | NaOH��Һ |