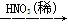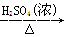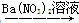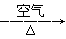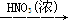题目内容
在密闭容器中充入4 mol SO2和3 mol O2,一定条件下建立如下平衡:2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为
2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为
A.2Q kJ B.Q kJ C.1.8Q kJ D.0.9Q kJ
C
【解析】
试题分析:设反应放出的热量为x,
由2SO2(g)+O2(g)?2SO3(g)△H=-Q KJ/mol
2 QkJ
4mol×90% x
2/ (4mol×90%)=QkJ/x
解得x=1.8QkJ, 故选C
考点:化学平衡的有关计算

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案用0.1320 mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 22.60 |
回答下列问题:
(1)图中甲为 滴定管,乙为 滴定管(填“酸式”或“碱式 ”);
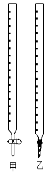
(2)取待测液NaOH溶液25.00 mL 于锥形瓶中,使用 做指示剂,滴定终点的判断依据是 ;
(3)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果 (填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果 ;
(4)该NaOH溶液的物质的量浓度为 mol/L (保留小数点后四位有效数字)。