��Ŀ����
����Ŀ��������ȫ����������������![]() �������
�������![]() ��������������ײ��ʱ��
��������������ײ��ʱ��![]() ��Ѹ�ٷֽ����
��Ѹ�ٷֽ����![]() ��Na��Na���ʿ���
��Na��Na���ʿ���![]() ������Ӧ�����������գ�
������Ӧ�����������գ�
![]() ԭ���������ӵĵ����Ų�ʽΪ______�������ĵ���ʽΪ______��
ԭ���������ӵĵ����Ų�ʽΪ______�������ĵ���ʽΪ______��
![]() �뽫
�뽫![]() ��
��![]() ��
��![]() �������Ӱ뾶�ɴ�С��˳������______
�������Ӱ뾶�ɴ�С��˳������______![]() �����ӷ���
�����ӷ���![]() ��
��
![]() �Ľ�����ǿ��Na����һ����ʵ˵��______��
�Ľ�����ǿ��Na����һ����ʵ˵��______��
![]() ��ƽNa��
��ƽNa��![]() ��Ӧ�Ļ�ѧ����ʽ�����������ת�Ƶķ�������Ŀ��
��Ӧ�Ļ�ѧ����ʽ�����������ת�Ƶķ�������Ŀ��
______![]() ______
______![]() ______
______![]() ______
______![]() ������״��������
������״��������![]() ������ת�Ƶĵ�����ĿΪ______
������ת�Ƶĵ�����ĿΪ______![]() ��
��
![]() �����
�����![]() �����
�����![]() �����۵�͵�ԭ��______��
�����۵�͵�ԭ��______��
���𰸡�![]()
![]()
![]() KOH�ļ��Ա�NaOH�ļ���ǿ 10 2 5 1
KOH�ļ��Ա�NaOH�ļ���ǿ 10 2 5 1 ![]()
![]() ��
��![]() �����Ϊ���Ӿ��壬��������ͬ��
�����Ϊ���Ӿ��壬��������ͬ��![]() ��
��![]() �뾶�������������ͬ������
�뾶�������������ͬ������![]() �����Ӽ���
�����Ӽ���![]() �����Ӽ�����
�����Ӽ�����![]() �����
�����![]() �����۵��
�����۵��
��������
��1��NԪ����7��Ԫ�أ�����������Ϊ5���Ų���2s��2p����ϣ�Nԭ���������ӵĵ����Ų�ʽΪ2s22p3�����������к���![]() ����������3�Թ��õ��Ӷԣ�����Nԭ�Ӿ��ﵽ8e���ṹ����������ʽΪ
����������3�Թ��õ��Ӷԣ�����Nԭ�Ӿ��ﵽ8e���ṹ����������ʽΪ![]() ��
��
��2��Na������O2����N3���������10�����ӣ�����������Ų���ͬ�����ӵĺ�������Ų���ͬʱ��ԭ������Խ�������Ӱ뾶ԽС�������������Ӱ뾶�ɴ�С˳��ΪN3��>O2��>Na����
��3��K��Na��Ϊ���ý�������ͨ���Ƚ�KOH��NaOH�ļ���ǿ���ж϶��߽����ԣ���ΪKOH�ļ��Դ���NaOH������K�Ľ�����ǿ��
��4������ʽ��Na�Ļ��ϼ�����1��N�Ļ��ϼ۽���5�����������о�����2��ԭ�ӣ�����ת�Ƶ���Ϊ10������NaΪ10��![]() Ϊ1���ٸ���ԭ���غ�õ���ѧ����ʽΪ
Ϊ1���ٸ���ԭ���غ�õ���ѧ����ʽΪ![]() ���õ����ŷ���ʾ����ת��Ϊ
���õ����ŷ���ʾ����ת��Ϊ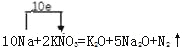 ���ɻ�ѧ����ʽ��֪��ÿ����
���ɻ�ѧ����ʽ��֪��ÿ����![]() ת��10mol���ӣ�������
ת��10mol���ӣ�������![]() ��
��![]() ʱ��ת�Ƶ���
ʱ��ת�Ƶ���![]() ת�Ƶ�����Ϊ
ת�Ƶ�����Ϊ![]() ��
��
��5��K2O��Na2O�����Ϊ���Ӿ��壬��������ͬ��![]() ��
��![]() �뾶�������������ͬ��
�뾶�������������ͬ��![]() �����Ӽ���
�����Ӽ���![]() �����Ӽ�����
�����Ӽ�����![]() �ľ����ܱ�
�ľ����ܱ�![]() ��С������
��С������![]() ���۵��
���۵��![]() �ĵͣ�
�ĵͣ�

����Ŀ��80 ��ʱ��2 L�ܱ������г���0.40 mol N2O4��������ӦN2O4(g)![]() 2NO2(g)����H����53 kJ/mol������������ݡ������ж���ȷ����
2NO2(g)����H����53 kJ/mol������������ݡ������ж���ȷ����
ʱ��/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol��L��1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
A. �����¶ȸ÷�Ӧ��ƽ�ⳣ��K��С
B. �÷�Ӧ�� ��S <0
C. ��Ӧ��ƽ��ʱ����15.9 kJ
D. 100 sʱ��ͨ��0.40 mol N2O4������ƽ��ʱN2O4�����������С






