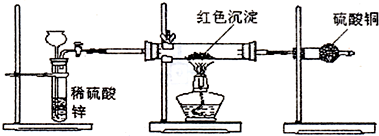
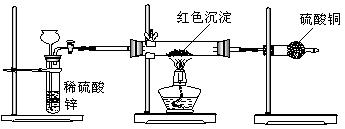
题目内容
(11分)2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子——丁烯和乙烯。

现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。

请按要求填空:
(1)写出下列反应的反应类型:①:_________,⑥:__________,⑧:_____________
(2)反应②的化学方程式是___________________________________________。
(3)反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是 ,物质E的结构简式是_______________。
(4)反应⑩的化学方程式是___________________________________________。
⑴ 取代反应 消去反应 加成反应
⑵
⑶ ④ 保护A分子中C=C不被氧化 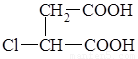
(4)
【解析】由反应①前后的有机物结构变化来分析,该反应是取代反应。根据所给的信息并结合结构简式可知,有机物CH2=CHCH2Cl在催化剂的作用下进行了烯烃换位,生成物的结构简式分别为CH2=CH2、CH2ClCH=CHCH2Cl。因为A可以和氢氧化钠溶液反应,B可以和单质溴反应,所以A是CH2ClCH=CHCH2Cl,B是CH2=CH2。B和单质溴发生加成反应,生成H,其结构简式为CH2BrCH2Br。H水解得到I,其结构简式为HOCH2CH2OH。根据J的结构简式并结合I的结构简式可得出G的结构简式为HOOCCH=CHCOOH,所以F的结构简式为NaOOCCH=CHCOONa。根据反应⑥的条件可知反应是卤代烃的消去反应,故E的结构简式为
HOOCCH2CHClCOOH。因为A水解得到C,其结构简式为HOCH2CH=CHCH2OH,根据E的结构特点可知需要把羟基氧化成羧基,但由于碳碳双键也容易被氧化,所以,在氧化羟基之前要先保护碳碳双键,故通过反应④将碳碳双键先加成,引入卤素原子,即D的结构简式为HOCH2CH2CHClCH2OH。当D中羟基被氧化成羧基后,再利用消去反应重新生成碳碳双键即可。

(分)(1)一种有机物结构为:![]() 。
。
该有机物不能发生的反应为 (填序号):①加成反应;②取代反应;③酯化反应;④水解反应;⑤加聚反应;⑥与金属钠反应放出H2;⑦在Cu或Ag催化下氧化为醛的反应
 (2)2005年诺贝尔化学奖授予法国和美国的伊夫??肖万、罗伯特??格拉布和理查德??施罗克,以表彰他们在烯烃复分解反应研究领域作出的
(2)2005年诺贝尔化学奖授予法国和美国的伊夫??肖万、罗伯特??格拉布和理查德??施罗克,以表彰他们在烯烃复分解反应研究领域作出的
卓越贡献。烯烃复分解反应如下所示(炔烃也能发生此类反应):
![]()
即从总效果看,是双键断裂交换成份重新组合。
①以下反应不属于烯烃复分解反应的是______________(填序号)。
 ②写出丙炔与丙炔发生复分解反应的化学方程式:
②写出丙炔与丙炔发生复分解反应的化学方程式:
__________________________________________________________________________。
③烯烃复分解反应可以合成其他反应难以合成的物质,写出用 制取
 |
的化学方程式:______________________________________________。
④人们在上世纪50年代已发现了烯烃复分解反应,到了70年代由伊夫??肖万揭示了反应机理,并制得了钛、钨、钼等金属卡宾。烯烃复分解反应有着广阔的应用前景。则后两位化学家所作的贡献应是_________(填序号,多项选择)。
(a)找到了更价廉的金属卡宾;(b)找到了在更多化学环境都有催化活性的金属卡宾;
(c)使反应原理转化为实际应用。