题目内容
为了证明[(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)]的成分中含有NH![]() 、Fe2+、SO
、Fe2+、SO![]() 和H2O,下列实验叙述中不正确的是( )
和H2O,下列实验叙述中不正确的是( )
A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+
C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO![]()
D.取少量硫酸亚铁铵放入试管,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中含有NH![]()
解析:将晶体加热,试管口有液体,可证明晶体中有结晶水,A项正确;Fe2+遇KSCN溶液不变色,加入氯水后可被氧化为Fe3+,溶液变血红色,可证明有Fe2+的存在,B项正确;溶液中加入盐酸酸化,再滴入BaCl2溶液,有白色沉淀生成,则可证明含有SO![]() ,C项正确;在溶液中加入稀NaOH溶液,不能产生NH3,故不能用湿润的红色石蕊试纸检验,D项错误。
,C项正确;在溶液中加入稀NaOH溶液,不能产生NH3,故不能用湿润的红色石蕊试纸检验,D项错误。
答案:D

练习册系列答案
 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
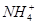 、
、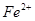 、
、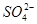 和H2O,下列实验叙述中不正确的是
和H2O,下列实验叙述中不正确的是