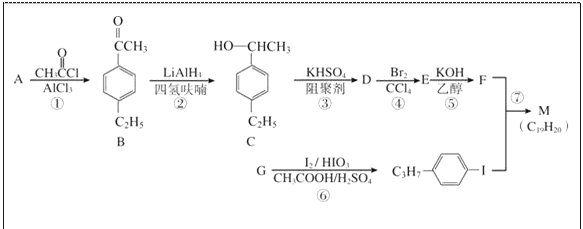
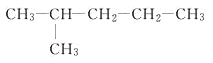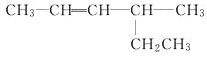题目内容
【题目】关于晶体的下列说法正确的是
A. 六方最密堆积的空间利用率是52%
B. 离子晶体中一定含金属阳离子
C. 在共价化合物分子中各原子都形成8电子结构
D. 分子晶体的熔点可能比金属晶体的熔点高
【答案】D
【解析】
A.六方最密堆积的空间利用率74%,简单立方堆积的空间利用率52%,故A错误;
B.铵盐属于离子晶体,铵盐中不含金属阳离子,故B错误;
C.H原子形成共价化合物时,H周围只有2个电子,所以在共价化合物分子中各原子不一定都形成8电子结构,故C错误;
D.Hg为金属,但常温下为液体,而S为分子晶体,在常温下为固体,分子晶体的熔点可能比金属晶体的熔点高,故D正确;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】Ⅰ.空白实验分析是化学实验中常用的一种方法,是指在不加样品的情况下,用与测定样品相同的方法、步骤进行定量分析,把所得结果作为空白值,从样品的分析结果中扣除,这样可以消除由于试剂不纯或试剂干扰等所造成的系统误差。
“凯氏定氮法”是经典的测定化合物或混合物中总氮量的一种方法。某化学实验小组成员想通过“凯氏定氮法”实验测定某品牌化肥中的氮含量。

实验流程如下:
步骤:①取10.00g化肥样品溶于水,定容至100mL;
②在烧杯中加入10.00mL步骤①中得到化肥水溶液和辅助试剂,加热使其充分反应;
③反应完毕,将反应液转移到大试管中;
④按如下装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);

⑤取下锥形瓶,滴加指示剂,用0.2500mol·L-1盐酸标准液滴定;
⑥重复实验操作。
数据记录如下:
实验编号 | 样品和辅助试剂 | 消耗盐酸体积(mL) |
1 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.18 |
2 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.70 |
3 | 10.00mL溶液、0.1g催化剂、20mL浓硫酸 | 33.22 |
4 | x |
请回答下列问题:
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的化学方程式为______________;H3BO3为一元弱酸,在水中发生反应H3BO3+H2O![]() [B(OH)4]-+H+。室温下,pH相同的硼酸溶液、盐酸中,水的电离程度__________(填“前者大”、“后者大”或“相同”);
[B(OH)4]-+H+。室温下,pH相同的硼酸溶液、盐酸中,水的电离程度__________(填“前者大”、“后者大”或“相同”);
(2)步骤④的实验装置中需要加热的仪器是___________(填仪器名称),长导管的作用是______________;
(3)编号为4的实验应加入的样品和辅助试剂为__________________________;
(4)计算该化肥中的氮含量为____克/每千克化肥(含x代数式表示,要求化简)。
Ⅱ.假设实验分析法也是化学实验常用的方法,以下实验研究影响化学反应速率的因素。
(1)已知KHSO3与KIO3反应的离子方程式为IO3-+3HSO3-==3SO42-+I-+3H+;一定量的KHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段速率突然增大。对其原因提出如下假设,请完成假设2。
假设1:生成的SO42-对反应起催化作用;
假设2:___________________________;
(2)请设计实验验证上述假设1,完成下表中内容。
实验步骤 | 预期实验现象和结论 |
在烧杯甲中将一定量的KHSO3溶液与KIO3溶液混合,用速率检测仪测定起始阶段速率v(甲); 在烧杯乙中先加入少量______(填试剂),其他条件与甲完全相同,用速率检测仪测定起始阶段速率v(乙)。 | 若v(甲)< (乙),则假设1成立 |
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
【题目】一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。

(1)△H____________ (填“>”“<”或“不能确定”)0。
(2)若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_______(填“>” “<”或“不能确定”)H2O。
Ⅱ.甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。

(2)在3 L容积可变的密闭容器中发生反应②,已知
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(3)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。

请写出加入(通入)b物质一极的电极反应式_________________;每消耗6.4g甲醇转移的电子数为_______________。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________。