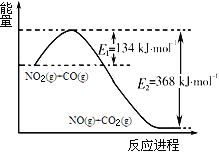
题目内容
【题目】(1)海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:
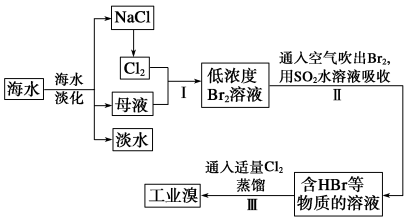
操作Ⅱ发生反应的离子方程式为: ;如果用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,则生成物中溴的化合价分别为+5和-1价,且操作Ⅲ中用稀硫酸代替氯气,请写出这种情况下操作Ⅲ中发生反应的离子方程式: 。
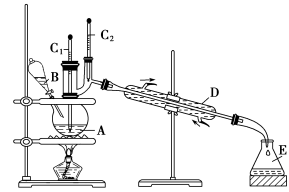
(2)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
上表为苯、溴和溴苯的相关数据 ,回答下列问题:
在A中加入30.0mL无水苯和少量铁屑。在B中小心加入8.0mL液态溴。
向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
① A的容积最适合的是________(填编号)。
a.25mL b.50mL c.100mL d.250mL
② 收集溴苯时,应根据_______(填“C1”或“C2”)所显示的温度,其温度应为__________。
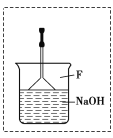
③ 在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,则用它可吸收承接到的所有物质有________________(填化学名称)。
④ 某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;
第二步:向其中加入过量的稀硝酸;
第三步:继续滴加少量的硝酸银溶液。
如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。该实验方案________(填“合理”或“不合理”),理由是: 。
【答案】(1)SO2+Br2+2H2O==SO+2Br-+4H+ ;BrO+5Br-+6H+==3Br2+3H2O
(2)① c;② C2;156℃;③ 溴、溴化氢、苯;④不合理;溴与氢氧化钠溶液反应生成溴化钠,也能产生浅黄色沉淀,无法确定是否生成溴化氢,即无法确定两者发生的是取代反应;
【解析】
试题分析:(1)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的.其反应离子方程式为:SO2+Br2+2H2O═SO42-+2Br-+4H+;生成物中溴的化合价分别为+5和-1价,在酸性条件下可归中反应生成溴,反应的方程式为:BrO3-+5Br-+6H+=3Br2+3H2O,故答案为:SO2+Br2+2H2O═SO42-+2Br-+4H+;BrO3-+5Br-+6H+=3Br2+3H2O;
(2)①蒸馏时,所加液体不超过蒸馏烧瓶的![]() ,则可用100mL的烧瓶;故选:c;
,则可用100mL的烧瓶;故选:c;
②C2用于测量溴苯的温度,由溴苯的沸点可知,所显示的温度为156℃,故答案为:C2;156℃;
③苯和溴发生取代反应生成溴化氢,苯、溴和溴化氢都易挥发,则在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有溴、溴化氢、苯,故答案为:Br2、HBr、C6H6;
④溴可与氢氧化钠反应生成溴化钠,与硝酸银反应生成溴化银沉淀,如检验是否生成溴化氢,应先通过苯除去溴,该实验原理不合理,故答案为:不合理;溴可以和NaOH溶液反应生成溴离子,也能产生浅黄色沉淀,无法确定是否生成溴化氢,即无法确定两者发生的是取代反应。