题目内容
大量排放CO2会加重温室效应,影响地球大气环境.为减少CO2对环境的影响,世界各国在限制其排放量的同时加强了对CO2创新利用的研究,如致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质,如甲醇、CH4、汽油 等.
I.目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已经成为一种趋势,这一做法的积极意义在于 .
II.有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经过化学反应后使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下:
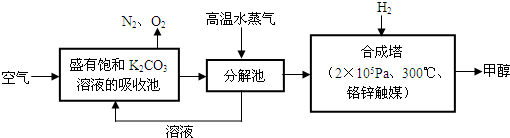
(1)吸收池中反应的化学方程式为: .
(2)在合成塔中,若有4.4kgCO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式 .
(3)控制不同的反应条件,CO2和H2反应还可以得到其它有机物.如将CO2和H2以1:4的体积比混合,在适当条件下反应,可获得重要能源CH4:CO2+4H2=CH4+2H2O;如将CO2和H2以1:3的体积比混合,还可生成某种重要的化工原料和水,该化工原料可能是 .
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(4)已知在443~473K时,用钴(Co)作催化剂可使CO2和H2生成C5~C8的烷烃,这是人工合成汽油的方法之一.要达到汽油的要求,CO2和H2体积比的取值范围应是 .
Ⅲ.若在一密闭恒容容器中充入CO2和H2的物质的量分别为1mol和3mol,发生反应得到CH3OH(g)和H2O(g).测得CO2和CH3OH(g)的浓度随时间变化如图所示:
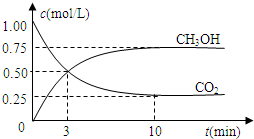
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L?min).
(2)下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2.
I.目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已经成为一种趋势,这一做法的积极意义在于
II.有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经过化学反应后使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下:

(1)吸收池中反应的化学方程式为:
(2)在合成塔中,若有4.4kgCO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式
(3)控制不同的反应条件,CO2和H2反应还可以得到其它有机物.如将CO2和H2以1:4的体积比混合,在适当条件下反应,可获得重要能源CH4:CO2+4H2=CH4+2H2O;如将CO2和H2以1:3的体积比混合,还可生成某种重要的化工原料和水,该化工原料可能是
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(4)已知在443~473K时,用钴(Co)作催化剂可使CO2和H2生成C5~C8的烷烃,这是人工合成汽油的方法之一.要达到汽油的要求,CO2和H2体积比的取值范围应是
Ⅲ.若在一密闭恒容容器中充入CO2和H2的物质的量分别为1mol和3mol,发生反应得到CH3OH(g)和H2O(g).测得CO2和CH3OH(g)的浓度随时间变化如图所示:

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=
(2)下列措施中能使n(CH3OH)/n(CO2)增大的是
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2.
分析:Ⅰ.根据氟利昂作致冷剂可导致臭氧空洞分析;
Ⅱ.(1)碳酸钾能和二氧化碳反应生成碳酸氢钾;
(2)n(CO2)=
=100mol,根据反应的方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)计算反应热;
(3)CO2和H2以1:3的体积比混合生成水,结合质量守恒判断产物;
(4)用钴(Co)作催化剂可使CO2和H2生成C5~C8的烷烃,根据方程式nCO2+(3n+1)H2→CnH2n+2+2nH2O计算;
Ⅲ.(1)反应的方程式为CO2(g)+3H2(g)?CH3OH(g)+H2O(g),由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,根据浓度变化量之比等于化学计量数之比氢气的浓度变化量,根据v=
计算v(H2);
(2)使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量.
Ⅱ.(1)碳酸钾能和二氧化碳反应生成碳酸氢钾;
(2)n(CO2)=
| 4400g |
| 44g/mol |
(3)CO2和H2以1:3的体积比混合生成水,结合质量守恒判断产物;
(4)用钴(Co)作催化剂可使CO2和H2生成C5~C8的烷烃,根据方程式nCO2+(3n+1)H2→CnH2n+2+2nH2O计算;
Ⅲ.(1)反应的方程式为CO2(g)+3H2(g)?CH3OH(g)+H2O(g),由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,根据浓度变化量之比等于化学计量数之比氢气的浓度变化量,根据v=
| △c |
| △t |
(2)使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量.
解答:解:I.氟利昂作致冷剂可导致臭氧空洞,则用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂,可保护臭氧层,
故答案为:保护臭氧层;
Ⅱ.(1)碳酸钾能和二氧化碳反应生成碳酸氢钾,反应的方程式为K2CO3+CO2+H2O=2KHCO3,故答案为:K2CO3+CO2+H2O=2KHCO3;
(2)n(CO2)=
=100mol,放出4947kJ的热量,
则1molCO2反应可放出49.47kJ的热量,反应的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47 kJ?mol-1
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47 kJ?mol-1;
(3)由反应物CO2和H2混合在一定条件下以1:3(分子数比)比例发生反应,可判断混合气体中C、H原子个数比为1:6;又由于反应后生成水,即有H原子与O原子化合成水分子;而在四个选项中的物质中都不含O元素,可判断1个CO2分子中的2个O原子应与4个H原子结合成2个水分子,即混合气体中的1个C原子应与2个H原子化合成化工原料;通过以上分析,可得出化工原料中C、H原子个数比应为1:2;而在CH4中C、H原子个数比为1:4,在C2H2中C、H原子个数比为1:1,在C2H4中C、H原子个数比为1:2,在C2H6中C、H原子个数比为1:3,
故答案为:B;
(4)由nCO2+(3n+1)H2→CnH2n+2+2nH2O可知,当生成C5H12时,n:(3n+1)=5:16,当生成C8H18时,n:(3n+1)=8:25,
故答案为:
≤V(CO2)/V(H2)≤
.
Ⅲ.(1)由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=
=0.225mol/(L?mon),
故答案为:0.225;
(2)使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量,
A.该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
故答案为:C、D.
故答案为:保护臭氧层;
Ⅱ.(1)碳酸钾能和二氧化碳反应生成碳酸氢钾,反应的方程式为K2CO3+CO2+H2O=2KHCO3,故答案为:K2CO3+CO2+H2O=2KHCO3;
(2)n(CO2)=
| 4400g |
| 44g/mol |
则1molCO2反应可放出49.47kJ的热量,反应的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47 kJ?mol-1
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47 kJ?mol-1;
(3)由反应物CO2和H2混合在一定条件下以1:3(分子数比)比例发生反应,可判断混合气体中C、H原子个数比为1:6;又由于反应后生成水,即有H原子与O原子化合成水分子;而在四个选项中的物质中都不含O元素,可判断1个CO2分子中的2个O原子应与4个H原子结合成2个水分子,即混合气体中的1个C原子应与2个H原子化合成化工原料;通过以上分析,可得出化工原料中C、H原子个数比应为1:2;而在CH4中C、H原子个数比为1:4,在C2H2中C、H原子个数比为1:1,在C2H4中C、H原子个数比为1:2,在C2H6中C、H原子个数比为1:3,
故答案为:B;
(4)由nCO2+(3n+1)H2→CnH2n+2+2nH2O可知,当生成C5H12时,n:(3n+1)=5:16,当生成C8H18时,n:(3n+1)=8:25,
故答案为:
| 5 |
| 16 |
| 8 |
| 25 |
Ⅲ.(1)由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=
| 2.25mol/L |
| 10min |
故答案为:0.225;
(2)使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量,
A.该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
故答案为:C、D.
点评:本题考查反应速率计算、化学平衡的计算与影响因素、平衡常数等,难度中等,注意利用化学反应方程式和质量守恒定律来推断物质的化学式,守恒方法是解答本题的常用方法,学生应熟悉元素守恒、原子守恒来解答此类习题.

练习册系列答案
相关题目