题目内容
已知可逆反应:M(g)+N(g)![]() P(g)+Q(g);△H>0,
P(g)+Q(g);△H>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1, c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
(2)若反应温度升高,M的转化率 (填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2 mol·L-1,a= 。
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)= bmol·L-1,达到平衡后,M的转化率为 。
(1)25%。(2)增大。(3)6。(4)41%。
解析:
(1)M转化的物质的量为0.6mol·L-1,则N反应的量也是0.6mol·L-1,所以N的转化率为:×100%=25%。
(2)由于该反应的正反应为吸热反应,所以升高温度,化学平衡正向移动,M的转化率增大。
(3) M(g)+N(g)![]() P(g)+Q(g)
P(g)+Q(g)
起始:1 2.4 0 0
平衡:0.4 1.8 0.6 0.6
起始:4 a 0 0
平衡:2 a-2 2 2
= ,a=6mol·L-1。
(4) = ,x=0.41b,M的转化率为41%。

(共10分)
(1)已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为_______________。
| A.加入一定量M | B.加入一定量N |
| C.反应温度升高 | D.缩小容器体积 |
②在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为_______________。此反应的化学平衡常数K=_______________。
③若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)="a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a=_______________mol·L-1。
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。
下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子(电子转移的方向如下图所示),电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2===2CO2+4H2O。则c电极是 (填“正极”或“负极”),c电极上发生的电极反应式为_____________________________________________。

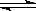 N2O4(g)△H<0。
N2O4(g)△H<0。
 P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
 N2O4(g) △H<0。
N2O4(g) △H<0。