题目内容
8.下列物质中属于强电解质的是②⑤⑥.①含有强极性键的HF ②不溶于水的BaSO4、AgCl ③稀H2SO4溶液 ④易溶于水的醋酸 ⑤Na2O、Na2O2、NaCl ⑥水溶液浓度为0.1mol•L-1,pH=1的HA ⑦NH3的水溶液⑧氯水.
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在溶液里全部电离的是强电解质,部分电离属于若电解质,电解质属于纯净物、化合物,据此解答即可.
解答 解:①含有强极性键的HF不易电离,属于弱电解质; ②不溶于水的BaSO4、AgCl,熔融状态下完全电离,属于强电解质; ③稀H2SO4溶液,是混合物,既不是电解质也不是非电解质; ④易溶于水的醋酸,醋酸是弱酸,是弱电解质; ⑤Na2O、Na2O2、NaCl均是强电解质; ⑥水溶液浓度为0.1mol•L-1,pH=1的HA,说明此酸完全电离,HA是强电解质; ⑦NH3的水溶液,是混合物既不是电解质也不是非电解质;⑧氯水是混合物,既不是电解质也不是非电解质,
故答案为:②⑤⑥.
点评 本题考查了强弱电解质的判断,把握电解质的定义,分清强弱电解质的本质区别,注意混合物既不是电解质也不是非电解质是解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列离子方程式书写错误的是( )
| A. | 在NaHSO4溶液中加Ba(OH)2至中性:Ba2++2OH-+2H++SO=BaSO4↓+2H2O | |
| B. | 向硫酸铜溶液中通入H2S气体:Cu2++H2S═CuS↓+2H+ | |
| C. | SO2气体通入Ba(OH)2溶液中:SO2+2OH-═SO | |
| D. | 用稀硫酸酸化硫化钠和亚硫酸钠的混合溶液:SO+2S2-+6H+═3S↓+3H2O |
16.下列物质中,发生消去反应生成的烯烃只有一种的是( )
①2丁醇
②2甲基2丙醇
③1丁醇
④2甲基2丁醇.
①2丁醇
②2甲基2丙醇
③1丁醇
④2甲基2丁醇.
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
3.为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是
( )
| 物质 | 试剂 | 分离方法 | |
| ① | 硝酸钾固体(氯化钠) | 蒸馏水 | 降温结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ④ | 氯气(氯化氢) | 饱和氯化钠溶液 | 洗气 |
| A. | ①③ | B. | ①④ | C. | 只有② | D. | ③④ |
13.下列比较不正确的是( )
| A. | 非金属性:C>N | B. | 酸性:HClO4>H2CO3 | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 热稳定性H2O>H2S |
20.下列各组离子,能在指定溶液中大量共存的是( )
| A. | 无色溶液中:Ba2+、HCO3-、NO3-、K+ | |
| B. | 能使紫色石蕊试剂变红的溶液中:NH4+、NO3-、CO32-、Na+ | |
| C. | 使酚酞试液变红的溶液:Na+、Ca2+、NO3-、Cl- | |
| D. | 有SO42-存在的溶液中:K+、Ba2+、Ag+、NO3- |
18.下列有关氯碱工业的描述,正确的是( )
| A. | 氯碱工业是指电解熔融氯化钠制取氯气的方法 | |
| B. | 氯碱工业只能得到氯气和氢氧化钠两种有价值的产品 | |
| C. | 实验室模拟氯碱工业制取氯气后所得溶液呈碱性 | |
| D. | 实验室模拟氯碱工业所得氯气不能直接排放,应用澄清石灰水吸收 |
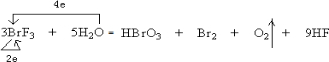 ,还原剂是H2O和BrF3,氧化剂是BrF3.氧化产物是HBrO3、O2. 还原产物是Br2(以上均填化学式)
,还原剂是H2O和BrF3,氧化剂是BrF3.氧化产物是HBrO3、O2. 还原产物是Br2(以上均填化学式)