题目内容
(10分)室温下取0.2 mol·L-1HA溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)①混合溶液中水电离出的c(OH-) 0.1mol·L-1NaOH溶液中水电离出的c(OH-);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+) -c(A-)= mol·L-1
c(OH-)-c(HA) = mol·L-1
(2)室温下如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH>7,则说明HA的电离程度 NaA的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为 。
(1)①混合溶液中水电离出的c(OH-) 0.1mol·L-1NaOH溶液中水电离出的c(OH-);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+) -c(A-)= mol·L-1
c(OH-)-c(HA) = mol·L-1
(2)室温下如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH>7,则说明HA的电离程度 NaA的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为 。
(1) ①>(2分) ②9.9×10-7(2分) 1.0×10-8(2分)
(2)<(2分) c(Na+)>c(A-)>c(OH-)>c(H+)(2分)
(2)<(2分) c(Na+)>c(A-)>c(OH-)>c(H+)(2分)
(1)①HA和氢氧化钠恰好反应,但溶液的pH=8,说明生成物水解显碱性,因此HA是弱酸。水解促进水的电离,区域内抑制水的电离,所以混合溶液中水电离出的c(OH-)>0.1mol·L-1NaOH溶液中水电离出的c(OH-)。
②根据电荷守恒定律可知c(Na+) +c(H+)=c(A-)+c(OH-),则c(Na+) -c(A-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9×10-7mol/L。根据质子守恒可知c(OH-)=c(H+)+c(HA) ,所以c(OH-)-c(HA)=c(H+)=1.0×10-8mol/L。
(2)根据酸和碱的量可知,HA是过量的,即反应后溶液中是HA和NaA的混合液,且浓度相等。测得混合溶液的pH>7,这说明HA的电离程度小于NaA的水解程度,所以溶液显碱性。因此溶液中各离子浓度由大到小的顺序为c(Na+)>c(A-)>c(OH-)>c(H+)。
②根据电荷守恒定律可知c(Na+) +c(H+)=c(A-)+c(OH-),则c(Na+) -c(A-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9×10-7mol/L。根据质子守恒可知c(OH-)=c(H+)+c(HA) ,所以c(OH-)-c(HA)=c(H+)=1.0×10-8mol/L。
(2)根据酸和碱的量可知,HA是过量的,即反应后溶液中是HA和NaA的混合液,且浓度相等。测得混合溶液的pH>7,这说明HA的电离程度小于NaA的水解程度,所以溶液显碱性。因此溶液中各离子浓度由大到小的顺序为c(Na+)>c(A-)>c(OH-)>c(H+)。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
 H3O+ +B2-
H3O+ +B2-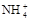 )最大的是( )
)最大的是( )