题目内容
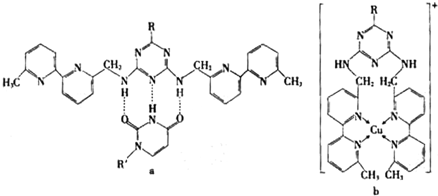
(2008?广东)某些高分子催化剂可用于有机合成.下面是一种高分子催化剂(Ⅶ)合成路线的一部分(Ⅲ和Ⅵ都是Ⅶ的单体;反应均在一定条件下进行;化合物Ⅰ-Ⅲ和Ⅶ中含N杂环的性质类似于苯环):

回答下列问题:
(1)写出由化合物Ⅰ合成化合物Ⅱ的反应方程式
 (不要求标出反应条件).
(不要求标出反应条件).
(2)下列关于化合物Ⅰ、Ⅱ和Ⅲ的说法中,正确的是
A.化合物Ⅰ可以发生氧化反应
B.化合物Ⅰ与金属钠反应不生成氢气
C.化合物Ⅱ可以发生水解反应
D.化合物Ⅲ不可以使溴的四氯化碳深液褪色
E.化合物Ⅲ属于烯烃类化合物
(3)化合物Ⅵ是
A.醇B.烷烃C.烯烃D.酸E.酯
(4)写出2种可鉴别V和Ⅵ的化学试剂
(5)在上述合成路线中,化合物Ⅳ和V在催化剂的作用下与氧气反应生成Ⅵ和水,写出反应方程式
 (不要求标出反应条件)
(不要求标出反应条件)

回答下列问题:
(1)写出由化合物Ⅰ合成化合物Ⅱ的反应方程式


(2)下列关于化合物Ⅰ、Ⅱ和Ⅲ的说法中,正确的是
AC
AC
(填字母).A.化合物Ⅰ可以发生氧化反应
B.化合物Ⅰ与金属钠反应不生成氢气
C.化合物Ⅱ可以发生水解反应
D.化合物Ⅲ不可以使溴的四氯化碳深液褪色
E.化合物Ⅲ属于烯烃类化合物
(3)化合物Ⅵ是
E
E
(填字母)类化合物.A.醇B.烷烃C.烯烃D.酸E.酯
(4)写出2种可鉴别V和Ⅵ的化学试剂
酸性高锰酸钾溶液、饱和碳酸钠溶液
酸性高锰酸钾溶液、饱和碳酸钠溶液
(5)在上述合成路线中,化合物Ⅳ和V在催化剂的作用下与氧气反应生成Ⅵ和水,写出反应方程式


分析:由化合物Ⅶ可知混合物Ⅵ为CH2=CH-0OCCH3,乙醇被酸性高锰酸钾氧化为CH3COOH,即Ⅴ,则Ⅳ因为CH2=CH2,解答本题时注意有机物官能团的性质,根据官能团的转化书写相关反应的化学方程式.
解答:解:由化合物Ⅶ可知混合物Ⅵ为CH2=CH-0OCCH3,乙醇被酸性高锰酸钾氧化为CH3COOH,即Ⅴ,则Ⅳ因为CH2=CH2,
(1)化合物Ⅰ合成化合物Ⅱ的反应为酯化反应,反应的方程式为 ,
,
故答案为: ;
;
(2)A.化合物Ⅰ含有-OH,可以发生氧化反应,故A正确;
B.合物Ⅰ含有-OH,与金属钠反应生成氢气,故B错误;
C.化合物Ⅱ含有酯基,可以发生水解反应,故C正确;
D.化合物Ⅲ含有C=C,可以使溴的四氯化碳深液褪色,故D错误;
E.化合物Ⅲ含有C、H、N等元素,属于烃的衍生物,故E错误.
故答案为:AC;
(3)化合物Ⅵ为CH2=CH-0OCCH3,含有酯基,属于酯类化合物,故答案为:E;
(4)V为CH3COOH,具有酸性,可与饱和碳酸钠溶液反应生成气体,Ⅵ为CH2=CH-0OCCH3,含有C=C,可与酸性高锰酸钾发生氧化还原反应,
故答案为:酸性高锰酸钾溶液、饱和碳酸钠溶液;
(5)Ⅳ为CH2=CH2,V为CH3COOH,Ⅵ为CH2=CH-0OCCH3,根据题意可知反应的方程式为 ,
,
故答案为: .
.
(1)化合物Ⅰ合成化合物Ⅱ的反应为酯化反应,反应的方程式为
 ,
,故答案为:
 ;
;(2)A.化合物Ⅰ含有-OH,可以发生氧化反应,故A正确;
B.合物Ⅰ含有-OH,与金属钠反应生成氢气,故B错误;
C.化合物Ⅱ含有酯基,可以发生水解反应,故C正确;
D.化合物Ⅲ含有C=C,可以使溴的四氯化碳深液褪色,故D错误;
E.化合物Ⅲ含有C、H、N等元素,属于烃的衍生物,故E错误.
故答案为:AC;
(3)化合物Ⅵ为CH2=CH-0OCCH3,含有酯基,属于酯类化合物,故答案为:E;
(4)V为CH3COOH,具有酸性,可与饱和碳酸钠溶液反应生成气体,Ⅵ为CH2=CH-0OCCH3,含有C=C,可与酸性高锰酸钾发生氧化还原反应,
故答案为:酸性高锰酸钾溶液、饱和碳酸钠溶液;
(5)Ⅳ为CH2=CH2,V为CH3COOH,Ⅵ为CH2=CH-0OCCH3,根据题意可知反应的方程式为
 ,
,故答案为:
 .
.点评:本题考查有机物的合成,题目难度中等,本题注意根据化合物Ⅶ可知混合物Ⅵ为解答该题的关键,答题时注意把握相关方程式的书写,把握有机物官能团的结构和性质.

练习册系列答案
相关题目
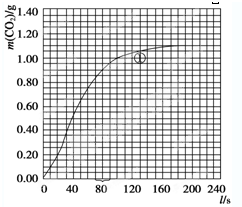

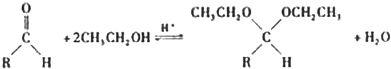
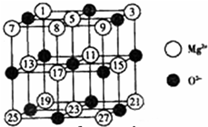 (2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
(2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁. 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: