题目内容
在右下图的实验装置中,从实验开始过一段时间,对看到的现象叙述不正确的是
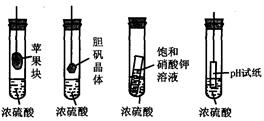

| A.苹果块会干瘪 | B.胆矾晶体表面有“白斑” |
| C.小试管内有晶体析出 | D.pH试纸变红 |
D
略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
题目内容

| A.苹果块会干瘪 | B.胆矾晶体表面有“白斑” |
| C.小试管内有晶体析出 | D.pH试纸变红 |

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案