题目内容
某合金中铜和铁的物质的量均为0.3mol,将其全部投入b mL 4mol?L-1的硝酸溶液中,使其充分反应(假设N0是唯一的还原产物).
(1)若金属有剩余,其质量为m1g,在溶液中再滴入稀硫酸后,剩余金属为m2g,则m1与m2的关系为:m1
(2)若b=450mL,则溶液中的阳离子为
(3)若合金与硝酸溶液恰好反应完全,求b的取值范围(要有计算过程).
(1)若金属有剩余,其质量为m1g,在溶液中再滴入稀硫酸后,剩余金属为m2g,则m1与m2的关系为:m1
>
>
(填“>”、“<”或“=”)m2.(2)若b=450mL,则溶液中的阳离子为
Fe3+、Fe2+、Cu2+
Fe3+、Fe2+、Cu2+
.(3)若合金与硝酸溶液恰好反应完全,求b的取值范围(要有计算过程).
分析:(1)反应后溶液中存在大量的NO3-,在酸性条件下具有强氧化性,可继续与金属反应;
(2)、(3)可能反应有3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,根据反应的方程式计算.
(2)、(3)可能反应有3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,根据反应的方程式计算.
解答:解:(1)反应后溶液中存在大量的NO3-,在酸性条件下具有强氧化性,可继续与金属反应,所以加入硫酸后,NO3-与金属继续发生氧化还原反应而溶解金属,所以金属的质量减小,
故答案为:>;
(2)n(HNO3)=0.45L×4mol/L=1.8mol,
可能反应有①3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
②3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
③Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,
铜完全反应消耗硝酸0.8 mol,
如发生反应②,0.3 mol Fe需要硝酸0.8 mol,
如发生反应③,0.3 mol Fe需要硝酸1.2mol,
而此时:0.8mol<(1.8mol-0.8mol)<1.2mol,
所以溶液中存在的离子有Fe3+、Fe2+、Cu2+,
故答案为:Fe3+、Fe2+、Cu2+;
(3)有关反应为:①3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
②3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
③Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,
根据方程式①计算,0.3mol Cu需要硝酸0.8 mol,
如果硝酸不足按方程式②计算,0.3mol Fe需要硝酸0.8 mol,
共需硝酸1.6mol,则b=400mL,
如果硝酸充足则按方程式③计算,0.3molFe需要硝酸1.2mol,
共需硝酸2mol,则b=500mL,
所以400mL≤b≤500mL,
答:b的取值范围为400mL≤b≤500mL.
故答案为:>;
(2)n(HNO3)=0.45L×4mol/L=1.8mol,
可能反应有①3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
②3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
③Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,
铜完全反应消耗硝酸0.8 mol,
如发生反应②,0.3 mol Fe需要硝酸0.8 mol,
如发生反应③,0.3 mol Fe需要硝酸1.2mol,
而此时:0.8mol<(1.8mol-0.8mol)<1.2mol,
所以溶液中存在的离子有Fe3+、Fe2+、Cu2+,
故答案为:Fe3+、Fe2+、Cu2+;
(3)有关反应为:①3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
②3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
③Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,
根据方程式①计算,0.3mol Cu需要硝酸0.8 mol,
如果硝酸不足按方程式②计算,0.3mol Fe需要硝酸0.8 mol,
共需硝酸1.6mol,则b=400mL,
如果硝酸充足则按方程式③计算,0.3molFe需要硝酸1.2mol,
共需硝酸2mol,则b=500mL,
所以400mL≤b≤500mL,
答:b的取值范围为400mL≤b≤500mL.
点评:本题考查混合物的计算,题目难度中等,本题注意根据反应的可能化学方程式,利用端值法计算,易错点为(3).

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
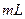 4
4  的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。学科网
的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。学科网 g,在溶液中再滴人稀硫酸后,剩余金属为
g,在溶液中再滴人稀硫酸后,剩余金属为 g,则
g,则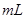 4
4
 的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。
的硝酸溶液中,使其充分反应(假设NO是唯一的还原产物)。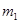 g,在溶液中再滴人稀硫酸后,剩余金属为
g,在溶液中再滴人稀硫酸后,剩余金属为 g,则
g,则