题目内容
同温同压下,等质量的CO和CO2比较
- A.所含碳原子个数比为1:1
- B.所含氧原子个数比为1:2
- C.所含氧元素的质量比为11:14
- D.所占体积比为7:11
C
分析:根据质量相同计算出两种物质的物质的量之比,结合阿伏加德罗定律及其推论计算并比较碳原子个数、氧原子个数、氧元素质量及其体积之间的关系.
解答:设两种气体的质量都是1g,则两种气体的物质的量之比=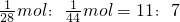 ,两种气体的分子数之比为11:7,
,两种气体的分子数之比为11:7,
A.一个CO和CO2中都含有一个碳原子,所以其碳原子个数之比等于其物质的量之比=11:7,故A错误;
B.一个CO中含有一个氧原子,一个CO2中含有2个氧原子,所以等质量的CO和CO2所含氧原子个数之比=11:14,故B错误;
C.两种气体的物质的量之比=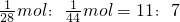 ,则两种气体中氧元素的质量比=(11×16):(7×32)=11:14,故C正确;
,则两种气体中氧元素的质量比=(11×16):(7×32)=11:14,故C正确;
D.同温同压下,气体的体积之比等于物质的量之比=11:7,故D错误;
故选C.
点评:本题考查物质的量的相关计算以及阿伏加德罗定律及其推论的有关知识,题目难度不大,注意有关公式的利用.
分析:根据质量相同计算出两种物质的物质的量之比,结合阿伏加德罗定律及其推论计算并比较碳原子个数、氧原子个数、氧元素质量及其体积之间的关系.
解答:设两种气体的质量都是1g,则两种气体的物质的量之比=
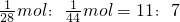 ,两种气体的分子数之比为11:7,
,两种气体的分子数之比为11:7,A.一个CO和CO2中都含有一个碳原子,所以其碳原子个数之比等于其物质的量之比=11:7,故A错误;
B.一个CO中含有一个氧原子,一个CO2中含有2个氧原子,所以等质量的CO和CO2所含氧原子个数之比=11:14,故B错误;
C.两种气体的物质的量之比=
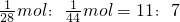 ,则两种气体中氧元素的质量比=(11×16):(7×32)=11:14,故C正确;
,则两种气体中氧元素的质量比=(11×16):(7×32)=11:14,故C正确;D.同温同压下,气体的体积之比等于物质的量之比=11:7,故D错误;
故选C.
点评:本题考查物质的量的相关计算以及阿伏加德罗定律及其推论的有关知识,题目难度不大,注意有关公式的利用.

练习册系列答案
相关题目
同温同压下,等质量的O2和CO2相比较,下列叙述正确的是( )
| A.体积比为8:11 | B.分子个数之比为11: 12 |
| C.物质的量之比为8:11 | D.原子个数之比为11: 12 |
同温同压下,等质量的O2和CO2相比较,下列叙述正确的是:
| A.体积比为8:1 | B.分子个数之比为11:12 |
| C.物质的量之比为8:11 | D.原子个数之比为11:12 |