��Ŀ����
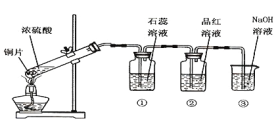
����Ŀ��ͬѧ����������ͼ��ʵ��װ�ý���Ũ�����ͭƬ��Ӧ��ʵ�飬̽��Ũ�����ڴ˷�Ӧ�е����á�
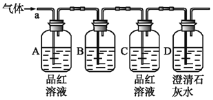
��1���ڷ�Ӧ��________�����������������������۲쵽�Թ��е�Һ�������ͭƬ��Ũ����ķ�Ӧ�ķ���ʽΪ__________��
��2��Ũ�����ڴ˷�Ӧ������______�ԣ���ѡ����ĸ��գ���A����B����ԭC������D����ˮ
��3�����Ƴ��ƾ��ƣ�����ͼ����װ����Ũ������ͭƬ��Ӧ��ʵ�飬�÷�Ӧ�����ӷ���ʽΪ_____���ܷ�����ˮ���ռ������壿_____����������������������գ����������û�ѧ��Ӧ����ʽ������ԭ��___________��
���𰸡����� Cu+2H2SO4(Ũ) ![]() CuSO4+SO2��+2H2O A��C Cu+4H++2NO3- = Cu2+ +2NO2��+2H2O ���� 3NO2+H2O=2HNO3+NO
CuSO4+SO2��+2H2O A��C Cu+4H++2NO3- = Cu2+ +2NO2��+2H2O ���� 3NO2+H2O=2HNO3+NO
��������
��1������Ũ�����м���û�������ƶ���ˮ���ӽ��н��
��2������ͭ��Ũ���ᷴӦ�ж����������塢����ͭ���ɽ��н��
��3��ͭ��Ũ���ᷴӦ��������ͭ������������ˮ��������������ˮ��Ӧ���������һ��������
��1��Ũ�����к��е�����ˮ����ȫ����������ӽ��Ϊˮ��������ӣ�Ũ�����м���û�������ƶ���ˮ���ӣ�������ͭƬ��Ũ���ᷴӦ�в��ܹ۲쵽�Թ��е�Һ�������ͭ��Ũ���ᷴӦ���ɶ����������塢����ͭ��ˮ����Ӧ����ʽ��Cu+2H2SO4(Ũ)![]() CuSO4+SO2��+2H2O��
CuSO4+SO2��+2H2O��
��2��ͭ��Ũ���ᷴӦ�ж��������������ɣ���Ԫ�ػ��ϼ۽��ͣ�������������ԣ�ͭ��Ũ���ᷴӦ��������ͭ���ɣ�Ũ����������ԣ���ѡA��C��
��3��ͭ��Ũ���ᷴӦ��������ͭ������������ˮ����Ӧ���ӷ���ʽ��Cu+4H++2NO3- = Cu2+ +2NO2��+2H2O��������������ˮ��Ӧ���������һ��������3NO2+H2O=2HNO3+NO�����Բ�������ˮ���ռ�NO2��

����Ŀ��25��ʱ����Ũ��Ϊ0.100 0 mol��L��1������������Һ�ֱ�ζ�20.00 mLŨ�Ⱦ�Ϊ0.100 0 mol��L��1�Ķ�����HX��HY(��������仯)��ʵ���������±��������жϲ���ȷ���� ( )
���ݱ�� | ����NaOH(aq)�����/mL | ��Һ��pH | |
HX | HY | ||
�� | 0 | 3 | 1 |
�� | a | 7 | x |
�� | 20.00 | >7 | y |
A. ����ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ���������HX<HY
B. �ɱ������ݿɹ����Ka(HX)��10��5
C. HY��HX��ϣ�c(H��)��c(X��)��c(Y��)��c(OH��)
D. �����ڷ�Ӧ���HY��Һ�У�c(Na��)>c(Y��)>c(OH��)>c(H��)