题目内容
将10.08 g铁粉溶于过量的稀硫酸,所得溶液中加入5.05 g KNO3氧化溶液中的Fe2+,待反应完毕后,剩余的Fe2+尚需30 mL 0.5 mol·L-1的溴水才能全部氧化,(1)通过计算推断KNO3被还原的产物。(2)试写出三步反应的化学方程式。
解析:(1)设生成的还原产物中氮元素价态降低x价,由得失电子守恒可知
得失电子守恒:
![]()
解得x=3,还原产物为NO。
(2)Fe+H2SO4====FeSO4+H2↑
6FeSO4+4H2SO4+2KNO3====3Fe2(SO4)3+K2SO4+2NO↑+4H2O
6FeSO4+3Br2====2Fe2(SO4)3+2FeBr3
答案:(1)NO
(2)Fe+H2SO4====FeSO4+H2↑
6FeSO4+4H2SO4+2KNO3====3Fe2(SO4)3+K2SO4+2NO↑+4H2O
6FeSO4+3Br2====2Fe2(SO4)3+2FeBr3

练习册系列答案
相关题目
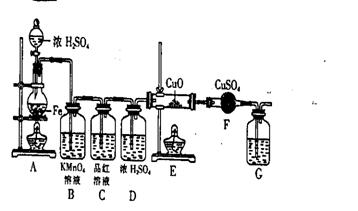 (2)随着反应的进行,B中酸性KMnO4溶液颜色逐渐变浅,请用离子方程式表示_______(3分)C中品红溶液颜色始终没有变化。
(2)随着反应的进行,B中酸性KMnO4溶液颜色逐渐变浅,请用离子方程式表示_______(3分)C中品红溶液颜色始终没有变化。