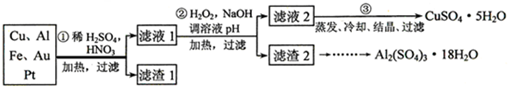
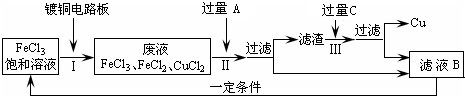
题目内容
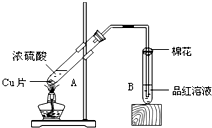
 某校化学小组的同学利用所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3?6H2O晶体。(图中夹持及尾气处理装置均略去)
某校化学小组的同学利用所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3?6H2O晶体。(图中夹持及尾气处理装置均略去)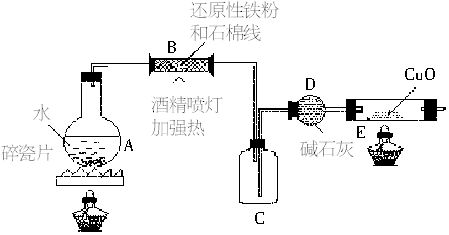
(1)装置B中发生反应的化学方程式是______
__________________________。
(2)装置E中的现象是____________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量的稀盐酸充分反应,过滤。简述检验滤液中含有Fe3+的操作方法:________________________。
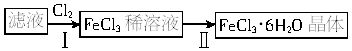
(4)该小组的同学利用上述滤液制取晶体,设计流程如下:
①步骤Ⅰ中通入Cl2的作用是________;②步骤Ⅱ从FeCl3稀溶液中得到FeCl3?6H2O晶体的主要操作包括__________;③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)__________。
(1)3Fe+4H2O(g)
 Fe3O4+4H2↑
Fe3O4+4H2↑(2)黑色固体变红,右端管壁有水珠
(3)取少量滤液,滴入几滴KSCN溶液,观察溶液的颜色是否变红
(4)①将Fe2+氧化成Fe3+ ②加热浓缩、冷却结晶、过滤 ③Fe3++3H2O=Fe(OH)3+3H+,过量盐酸可抑制Fe3+水解
【试题分析】
本题源于教材中实验的创新设计,考查铁及其化合物的性质。设计思路:制取水蒸气→制备氢气→干燥氢气→氢气还原氧化铜。铁粉与水蒸气反应生成四氧化三铁而不是氧化铁或氧化亚铁,一般观点认为四氧化三铁中含有氧化铁和氧化亚铁;检验Fe3+用KSCN溶液,观察溶液是否变红色:Fe3++3SCN-=Fe(SCN)3;制备氯化铁晶体必须将氯化亚铁转化成氯化铁,通入氯气将亚铁离子氧化成铁离子;从氯化铁稀溶液中得到氯化铁结晶水合物,显然不能蒸发溶液、灼烧,因为这样会失去结晶水。凡是得到易分解、易失去结晶水的晶体只能用冷却热饱和溶液,利用降低温度,溶质溶解度减小的规律,析出晶体。如制硫酸铜晶体、绿矾。氯化铁属于强酸弱碱盐,易发生水解,为了制得较纯净的氯化铁晶体,必须在过量的盐酸中进行,根据化学平衡移动原理,对于反应:FeCl3+3H2O=Fe(OH)3+3HCl,增加盐酸的浓度,使化学平衡向左移动。

练习册系列答案
相关题目
 某校化学小组的同学欲用如图所示装置在实验室中制取氨气,
某校化学小组的同学欲用如图所示装置在实验室中制取氨气,