题目内容
8.下列说法正确的是( )| A. | 二氧化碳分子中存在共价键和分子间作用力 | |
| B. | 甲烷、氨和双氧水都是只由极性键结合而成的分子 | |
| C. | 同主族不同元素的最高价氧化物的水化物从上到下酸性递增 | |
| D. | 氟化氢的沸点高于氯化氢的沸点,水的沸点高于硫化氢的沸点 |
分析 A.二氧化碳分子间存在分子间作用力,分子内存在化学键;
B.结构对称,正负电荷的中心重合,则为非极性分子;极性分子中正负电荷的中心不重合,具有一定的极性;
C.元素的非金属性越强,其最高价氧化物的水化物的酸性越强;
D、同主族的氢化物,分子间存在氢键的沸点较高.
解答 解:A.二氧化碳分子中存在共价键、分子间存在分子间作用力,分子中不存在分子间作用力,故A错误;
B.CH4中含有极性键,空间结构为正四面体,正负电荷的中心重合,属于非极性分子,H2O2中含有极性键,空间结构不对称,属于极性分子;NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物的酸性越强,同主族从上到下非金属性减弱,则最高价氧化物的水化物酸性减弱,故C错误;
D.氟化氢分子间存在氢键,氟化氢所以的沸点高于氯化氢的沸点,水分子间存在氢键,所以水的沸点高于硫化氢的沸点,故D正确;
故选D.
点评 本题考查化学键和分子间作用力,熟悉常见元素之间的成键是解答本题的关键,注意化学键、空间构型与分子的极性的有关.

练习册系列答案
相关题目
19.某同学受硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2的启发,提出过量氯气与铁反应生成FeCl3、氯气与过量铁粉反应生成FeCl2的观点.为了验证该观点是否正确,该同学将一定量铁粉与Cl2恰好完全反应得到一固体物质A,然后通过实验确定其成分.探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设1:该固体物质是FeCl2;
假设2:该固体物质是FeCl3;
假设3:该固体物质是FeCl3和FeCl2.
(2)设计实验方案:
取少量固体物质A于烧杯中,加适量水溶解A,然后取两份A溶液分别进行实验,实验现象与结论如下表:(请在表格的横线处填空)
(3)已知 Fe(NO3)2溶液为浅绿色,往Fe(NO3)2溶液中加入少量的稀硫酸,溶液颜色有何变化(请把答案写在横线上)由浅绿色变为黄色,该变化过程的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(4)取100mL0.2mol/L的FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是CD(设溶液体积不变,不考虑水解因素).
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,c(Cl-)=0.6mol/L D.烧杯中Fe、Cu均有,c(Fe2+)=0.3mol/L
(5)在FeSO4的溶液中加入与FeSO4等物质的量的Na2O2固体,恰好使FeSO4转化为Fe(OH)3,写出该反应的离子方程式4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+.
(1)提出假设:(请把下列假设补充完整)
假设1:该固体物质是FeCl2;
假设2:该固体物质是FeCl3;
假设3:该固体物质是FeCl3和FeCl2.
(2)设计实验方案:
取少量固体物质A于烧杯中,加适量水溶解A,然后取两份A溶液分别进行实验,实验现象与结论如下表:(请在表格的横线处填空)
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
(4)取100mL0.2mol/L的FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是CD(设溶液体积不变,不考虑水解因素).
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,c(Cl-)=0.6mol/L D.烧杯中Fe、Cu均有,c(Fe2+)=0.3mol/L
(5)在FeSO4的溶液中加入与FeSO4等物质的量的Na2O2固体,恰好使FeSO4转化为Fe(OH)3,写出该反应的离子方程式4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+.
16.下列粒子不属于官能团的是( )
| A. | -Cl | B. | -CH2CH3 | C. | -OH | D. | -CHO |
3.探究:1-氯丙烷与NaOH乙醇溶液的反应
学习小组在进行1-氯丙烷与NaOH乙醇溶液的反应中,观察到有气体生成.
请你设计两种不同的方法分别检验该气体.在答题卡的方框中写出装置中所盛试剂的名称(试剂任选)和实验现象.
学习小组在进行1-氯丙烷与NaOH乙醇溶液的反应中,观察到有气体生成.
请你设计两种不同的方法分别检验该气体.在答题卡的方框中写出装置中所盛试剂的名称(试剂任选)和实验现象.
| 装置图 | 所盛试剂 | 实验现象 | |
| 1 | 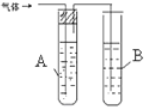 | A是 水 B是 酸性高锰酸钾溶液 | |
| 2 | 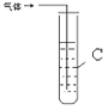 | C是 溴的四氯化碳溶液 |
20.一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g);△H<0.现将1mol A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )


| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
18.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 8g18O2含有的中子数为5NA | |
| B. | 1molFeI2与足量Cl2氯气充分反应转移的电子数为2NA | |
| C. | 标准状况下22.4LNO与11.2LO2混合后的气体分子数约为NA | |
| D. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |

 如图表示反应N2(g)+3H2(g)?2NH3(g);△H<0 在某一时间段反应速率与反应过程的曲线关系图,
如图表示反应N2(g)+3H2(g)?2NH3(g);△H<0 在某一时间段反应速率与反应过程的曲线关系图, 系统命名法命名为5-甲基-4-乙基-3-庚烯
系统命名法命名为5-甲基-4-乙基-3-庚烯 系统命名法命名为1,3二甲基苯
系统命名法命名为1,3二甲基苯 .
.