题目内容
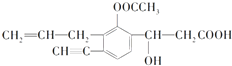
【题目】如图为短周期一部分.A,C两元素原子核外分别有两个、一个未成对电子.试回答: 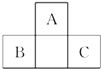
(1)B,C两种原子的电子排布式、 .
(2)短周期元素D与A同主族,则A,B,D三种元素形成的氢化物的分子构型分别是、、;已知氢化物分子中,A,B,D原子的孤电子对均在杂化轨道内,则A,B,D原子的杂化类型分别是、、;A,B,C,D四种元素氢化物的稳定性由强到弱的顺序为 .
(3)短周期元素E原子核外也有两个未成对电子,且E是形成化合物最多的元素,其常见的同素异形体的名称是、 .
【答案】
(1)1s22s22p63s23p3;1s22s22p63s23p5
(2)V形;三角锥形;V形;sp3;sp3;sp3;H2O>HCl>H2S>PH3
(3)金刚石;石墨
【解析】解:由元素在周期表中的位置可知,A处于第二周期,B、C处于第三周期,A、C两元素原子核外分别有两个、一个未成对电子,且为相邻的族,最外层电子数相差1,故A、C原子的p能级各轨道都应填充电子,则A核外电子排布为1s22s22p4 , C的核外电子排布为1s22s22p63s23p5 , 故A为氧元素,C为Cl元素,B为P元素,(1)B为P元素,电子排布式为1s22s22p63s23p3 , C为Cl元素,电子排布式为1s22s22p63s23p5 ,
所以答案是:1s22s22p63s23p3;1s22s22p63s23p5; (2)短周期元素D与A同主族,则D为硫元素,O、S形成的氢化物的分子构型相似,由于中心原子的价层电子对数为 ![]() =4,中心原子杂化类型为sp3杂化,中心都有两对孤电子对,所以它们的分子构型都是 V形,PH3中,P原子的价层电子对数为
=4,中心原子杂化类型为sp3杂化,中心都有两对孤电子对,所以它们的分子构型都是 V形,PH3中,P原子的价层电子对数为 ![]() =4,中心原子杂化类型为sp3杂化,有一对孤电子对,所以PH3的分子构型三角锥形,根据元素周期律,同主族元素从上向下,氢化物稳定性减弱,同周期元素从左向右,氢化物的稳定性增强,所以A、B、C、D四种元素氢化物的稳定性由强到弱的顺序为H2O>HCl>H2S>PH3 ,
=4,中心原子杂化类型为sp3杂化,有一对孤电子对,所以PH3的分子构型三角锥形,根据元素周期律,同主族元素从上向下,氢化物稳定性减弱,同周期元素从左向右,氢化物的稳定性增强,所以A、B、C、D四种元素氢化物的稳定性由强到弱的顺序为H2O>HCl>H2S>PH3 ,
所以答案是:V形;三角锥形;V形;sp3;sp3;sp3;H2O>HCl>H2S>PH3;(3)短周期元素E原子核外也有两个未成对电子,且E是形成化合物最多的元素,则E为碳元素,其常见的同素异形体有金刚石、石墨,
所以答案是:金刚石、石墨.

 名校课堂系列答案
名校课堂系列答案【题目】二氧化硫的含量是空气质量监测的一个重要指标。
I.二氧化硫被雨水吸收后就形成了酸雨,某兴趣小组同学汲取热电厂附近的雨水进行实验。
①测得该雨水样品的pH为4.73;
②每隔1h,通过pH计测定雨水样品的pH,测得的结果如表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为_______________。
(2)分析上述数据变化,你认为形成这一变化的原因是____________(用化学反应方程式表示)。
II.兴趣小组同学为测定空气中二氧化硫的体积分数,做了如下实验:取标准状况下的空气1.000L(内含氮气、氧气、二氧化硫、二氧化碳等),慢慢通过足量氯水,(反应的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀过滤、洗涤、干燥,称得其质量为0.233g。
(1)过滤后,洗涤沉淀中附着的过量氯化钡的方法是________________。
(2)计算该空气样品中二氧化硫的体积分数_________。