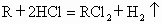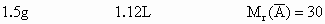题目内容
将1.5g两种金属的混合物粉末与足量的稀盐酸反应,反应完全后,得到标准状况下的氢气1.12L,则两种金属可能是
[ ]
A.Mg和Cu
B.Zn和Cu
C.Al和Fe
D.Mg和Al
答案:AC
解析:
解析:
|
Mg、Zn、Fe和稀盐酸反应均生成+2价的金属离子,不妨先假定混合金属均显+2价,按得到氢气的体积可求出混合物粉末中两种金属的平均相对原子质量 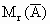 .根据反应方程式,有 .根据反应方程式,有
选项中+ 2价金属的相对原子质量,Mg~24,Fe~56,Zn~65.Al为+3价金属,现把它折合成+2价,其“相对原子质量”为27×(2/3)=18.Cu不反应,其“相对原子质量”看成大于 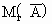 . .
两种金属的平均相对原子质量为 30,则必有一种金属相对原子质量大于30,另一种金属相对原子质量小于30.满足此条件的选项为A、C. |

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目