题目内容
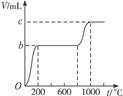
有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,把它们溶于足量的水中,充分反应后,溶液中Ca2+,CO32-、HCO32-均转化为沉淀,将反应器内水分蒸干,最后得到白色固体物质共29g,则原混合物中Na2CO3的质量是多少?
10.6g
按一般的常规解法——运用化学方程式列出方程组进行求解的话,很难获得正确答案。如果根据题意,远用微粒(Na+,CO32-)守恒的原理剖析题意,会很快找到解题的捷径。
从“溶液中的Ca2+、CO32-、HCO3-均转化为沉淀”可知:原混合物中Na2CO3和NaHCO3的物质的量之和必定等于CaO的物质的量。而最后得到的白色固体中NaOH的物质的量必定等于原混合物中Na2CO3、NaHCO3和NaOH中所含Na+的物质的量之和,可图示如下:

由上图解不难看出,质量差29-27.2=1.8(g)的实质,相当于x mol Na2O转化为2x mol NaOH的质量差。
即:Na2O→2NaOH Δm
1mol 80g 80g-62g=18g
xmol 29g-27.2g=1.8g
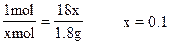
所以:含Na2CO3为10.6g。
从“溶液中的Ca2+、CO32-、HCO3-均转化为沉淀”可知:原混合物中Na2CO3和NaHCO3的物质的量之和必定等于CaO的物质的量。而最后得到的白色固体中NaOH的物质的量必定等于原混合物中Na2CO3、NaHCO3和NaOH中所含Na+的物质的量之和,可图示如下:

由上图解不难看出,质量差29-27.2=1.8(g)的实质,相当于x mol Na2O转化为2x mol NaOH的质量差。
即:Na2O→2NaOH Δm
1mol 80g 80g-62g=18g
xmol 29g-27.2g=1.8g
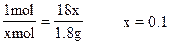
所以:含Na2CO3为10.6g。

练习册系列答案
相关题目