题目内容
14.碱金属Li的性质与碱土金属Mg相似,可以在加热条件下与N2化合生成氮化锂,氮化锂常温下与水反应生成氨,氨经一系列反应可生成硝酸,此过程中可用来人工固氮,写出氮化锂与水反应的化学方程式Li3N+3H2O=3LiOH+NH3↑,若用此方程式来固氮,2.1kg Li最多可制得硝酸铵2.8kg.分析 氮化锂常温下与水反应生成氨和氢氧化锂,根据氮元素守恒计算.
解答 解:氮化锂常温下与水反应生成氨和氢氧化锂,其反应的方程式为Li3N+3H2O=3LiOH+NH3↑,
由氮元素和Li元素守恒:3Li~Li3N~NH3~$\frac{1}{2}$NH4NO3
3×10 $\frac{1}{2}$×80
2.1kg m
则m=$\frac{2.1kg×\frac{1}{2}×80}{3×10}$=2.8kg,
故答案为:Li3N+3H2O=3LiOH+NH3↑;2.8.
点评 本题考查了方程式的书写、有关方程式的计算,题目难度不大,注意把握元素守恒在计算中应用.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
4.迷迭香酸是从蜂花属植物中提取得到的酸性物质如图.下列取叙述正确的是( )
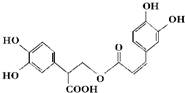

| A. | 迷迭香酸属于芳香烃 | |
| B. | 1 mol迷迭香酸最多能和9 mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、取代反应和酯化反应 | |
| D. | 1 mol迷迭香酸最多能和含5 mol NaOH的水溶液完全反应 |
5.下列有关化学反应表达正确的是( )
| A. | 甲醛溶液与足量的银氨溶液共热:HClO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| B. | 同位素示踪法研究酯化反应:CH3COOH+H18OCH2CH3$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH3+H218O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
2.化学物质的泄漏给居民生活和环境造成严重污染.下列有关说法正确的是( )
| A. | 液氨是纯净物,而氯水是电解质,漂白粉是混合物 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯气分子具有强氧化性 | |
| C. | 随着化合价的升高,氯的含氧酸的酸性逐渐增强 | |
| D. | 双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染 |
9.下列化学式既能表示物质的组成,又能表示物质的分子式的是( )
| A. | NH4NO3 | B. | SiO2 | C. | H4C2O2 | D. | Cu |
19.下列说法错误的是( )
| A. | 煤的气化、液化和干馏都属于化学变化 | |
| B. | 石油的裂化可以提高轻质油的产量和质量 | |
| C. | 石油分馏可获得乙烯、丙烯 | |
| D. | 苯等有机物是从煤干馏产物中分离出来的 |
6.分子式为C6H14的链烃中,主链有4个碳原子的同分异构体有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
3.下列说法中正确的是( )
| A. | H2和D2互为同位素 | B. | 正丁烷和异丁烷互为同系物 | ||
| C. |  与 与 互为同分异构体 互为同分异构体 | D. |  和 和  是同一种物质 是同一种物质 |
4.卤代烃能发生下列反应:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr.下列有机物中,可合成环烷烃的是( )
| A. | CH3CH2CH2Br | B. | CH3CH2CHBr2 | C. | CH2BrCH2CH2Br | D. | CH3CHBrCH2CH2Br |