题目内容
农民使用的氮肥主要是“氢铵”和尿素。某化学兴趣小组对某“氢铵”化肥进行了专项研究:
(1)预测:根据已有知识和“氢铵”的名称,该小组预测该“氢铵”是碳酸或亚硫酸或硫酸的铵盐。
(2)验证和探究:①NH4+的验证:取少量固体药品于试管中,然后 。
②阴离子的探究: a.取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将
产生的气体通入下列装置。观察到的现象是:溴水无明显变化,澄清石灰水变浑浊。
再向滴加稀盐酸反应后的试管中,加Ba(OH)2溶液,无明显现象。
Ⅰ.初步结论:“氢铵”是 的铵盐。
Ⅱ.要进一步确定“氢铵”的成分还需要补做如下实验:取适量“氢铵”配制成溶液,取试液于一支洁净的试管中, 。
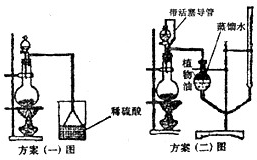
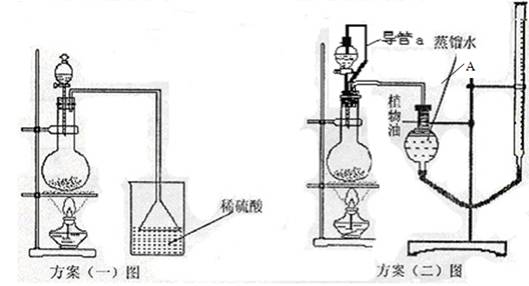
(3)该实验小组设计了以下二个实验方案测定该化肥的含氮量,请你阅读后解释方案中提出的问题并进行评价: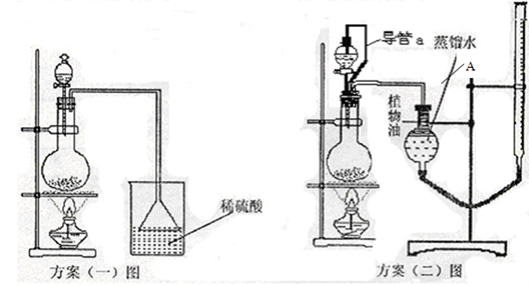
方案(一):准确称取一定质量的样品,放入上图方案(一)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置,通过实验测定烧杯增加的质量(忽略漏斗中附着溶液的质量)。然后进行计算,可得化肥的含氮量。
方案(二):准确称取一定质量的样品,放入上图方案(二)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置(A管可以上下移动),测量生成的氨气体积(设所测体积为标准状况下的体积)。然后进行计算,可得化肥的含氮量。
方案(二)图中导管a的作用是 。
请你评价上述两套方案是否合理。若合理只需要说明结论;若不合理,请简要说明原因,并指出修改方案(若要添加仪器、药品,请说明添加的位置、名称)
方案(一):
方案(二):
①滴加NaOH浓溶液,将湿润的红色石蕊试纸置于试管口部,加热试管,若红色石蕊试纸变蓝,则证明含NH4+。
②I、碳酸;
II、加足量BaCl2溶液振荡充分反应,若不产生白色沉淀,说明该化肥主要成分为NH4HCO3;若产生白色沉淀,过滤,取滤液加适量的Ba(OH)2溶液,也产生白色沉淀,说明该化肥主要成分为(NH4)2CO3和NH4HCO3的混合物;若不产生白色沉淀,说明该化肥主要成分为(NH4)2CO3。
(3)导管a的作用:保持烧瓶与分液漏斗的压强相同,使分液漏斗中的液体顺利流出;滴入锥形瓶的氢氧化钠溶液体积等于进入分液漏斗的气体体积,从而消除由于加入氢氧化钠溶液引起的氢气体积误差。
方案(一):不合理;装置中没有干燥装置,稀硫酸吸收了较多水蒸汽,误差太大;在烧杯前加一个装由碱石灰的干燥管。
方案(二):合理。
解析考点:几种化学肥料的鉴别;探究物质的组成或测量物质的含量.
专题:实验探究和数据处理题.
分析:(1)铵根离子的检验方法:加入氢氧化钠加热产生能使湿润的红色石蕊试纸变蓝的氨气;
(2)能使石灰水变浑浊的气体是二氧化碳或者是二氧化硫气体,亚硫酸盐具有还原性,能被溴水氧化,碳酸盐可以和氯化钡反应生成沉淀,氯化钡和碳酸氢盐不反应;
(3)铵盐和氢氧化钠反应生成的氨气中混有水,会干扰氨气质量的测定;水和植物油混不相溶,可以采用排植物油的方法来获得生成氨气的体积,进而确定铵盐的质量.
解答:解:(1)根据铵根离子的检验方法:想可溶性的铵盐中加入氢氧化钠,并加热,能产生能使湿润的红色石蕊试纸变蓝的氨气则能证明含NH4+,
故答案为:NaOH;湿润的红色石蕊试纸;变蓝;
(2)a、能使石灰水变浑浊的气体是二氧化碳或者是二氧化硫气体,亚硫酸盐具有还原性,能被溴水氧化,如果是碳酸氢盐,则会和氢氧化钡反应生成碳酸钡白色沉淀,
故答案为:碳酸;
b、加足量BaCl2溶液振荡充分反应,若不产生白色沉淀,说明是碳酸氢铵,不是碳酸铵,碳酸铵可以和氯化钡反应生成碳酸钡沉淀,所以当产生白色沉淀时,说明是碳酸铵,
故答案为:NH4HCO3;(NH4)2CO3和NH4HCO3的混合物;
(3)铵盐和氢氧化钠反应生成的氨气中混有水,会干扰氨气质量的测定,必须对氨气进行干燥,所以方案(一)不合理;而水和植物油混不相溶,可以采用排植物油的方法来获得生成氨气的体积,进而确定铵盐的质量,即方案(二)合理,
故答案为:不合理,装置中没有干燥装置,吸收了较多水蒸汽(或烧瓶中有氨气残留);合理.
点评:本题是一道有关化学肥料的物质组成和判断的题目,考查学生分析和解决问题的能力,难度较大.

 阅读快车系列答案
阅读快车系列答案