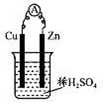
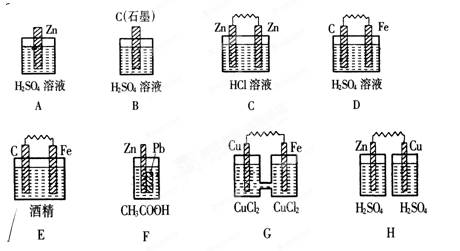
题目内容
控制适当的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
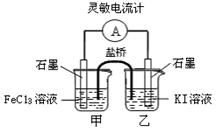
 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
| A.反应开始时,乙中电极反应为2I--2e-= I2 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.平衡时甲中溶入FeCl2固体后,电流计读数为零 |
D
试题分析:反应开始时铁离子、碘离子浓度最大,则电池总反应为2Fe3++2I-=2Fe2++I2,则乙中碘元素由—1升为0价,失去电子,发生氧化反应,即2I--2e-= I2,说明乙烧杯中石墨是负极,故A正确;甲中铁元素由+3降为+2价,得到电子,发生还原反应,即2 Fe3++2 e-=2Fe2+,说明甲中石墨是正极,故B正确;反应开始时,正反应速率大于逆反应速率,电子从乙中石墨经过导线、灵敏电流计流向甲中石墨的速率大,而电子从甲中石墨经过导线、灵敏电流计流向乙中石墨的速率小,当电流计读书为零时,正反应速率等于逆反应速率,消耗的铁离子与生成的铁离子相等,达到化学平衡状态,故C正确;甲中加入氯化亚铁固体后,增大亚铁离子浓度,平衡向逆反应方向移动,电池总反应变为2Fe2++I2=2Fe3++2I-,则甲中石墨变为负极,反应变为2Fe2+—2e-=2Fe3+,乙中石墨变为正极,反应变为I2+2e-=2I-,电子从甲中石墨经过导线、灵敏电流计流向乙中石墨的速率大,而电子从乙中石墨经过导线、灵敏电流计流向甲中石墨的速率小,灵敏电流计读数增大,故D不正确。

练习册系列答案
相关题目
 (1)工业上可利用反应Na(1)+ KCl(1) K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___ _____,
(1)工业上可利用反应Na(1)+ KCl(1) K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___ _____,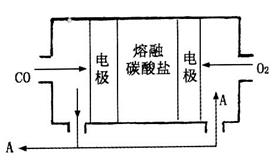


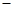 2e-=CO2
2e-=CO2