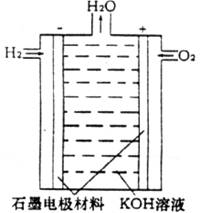
题目内容
有一种氢氧燃料电池以30%KOH溶液为电解质溶液,工作时的电极反应如下:
2H2+4OH-- 4e-=4H2O O2+2H2O+4e-=4OH-,下列说法中错误的是
- A.电池工作时,电子由负极通过外电路流向正极
- B.标准状况下,反应3.36L氢气,转移电子0.2mol
- C.氢氧燃料电池能量利用率高于氢气直接燃烧的能量利用率
- D.产物为无污染的水,属于环境友好电池
B
试题分析:A、原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以A正确;B、标准状况下3.36L氢气的物质的量是3.36L÷22.4L/mol=0.15mol,氢气再反应中失去2个电子,因此0.15mol氢气再反应中失去0.15mol×2=0.3mol电子,B不正确;C、燃料电池是一种高效、环境友好的发电装置,因此氢氧燃料电池能量利用率高于氢气直接燃烧的能量利用率,C正确;D、氢氧燃料电池的生成物是水,没有污染,属于环境友好电池,D正确,答案选B。
考点:考查氢氧燃料电池的有关判断
试题分析:A、原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以A正确;B、标准状况下3.36L氢气的物质的量是3.36L÷22.4L/mol=0.15mol,氢气再反应中失去2个电子,因此0.15mol氢气再反应中失去0.15mol×2=0.3mol电子,B不正确;C、燃料电池是一种高效、环境友好的发电装置,因此氢氧燃料电池能量利用率高于氢气直接燃烧的能量利用率,C正确;D、氢氧燃料电池的生成物是水,没有污染,属于环境友好电池,D正确,答案选B。
考点:考查氢氧燃料电池的有关判断

练习册系列答案
相关题目