题目内容
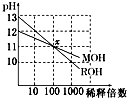 (2012?上海模拟)两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是( )
(2012?上海模拟)两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是( )分析:A、根据MOH和ROH溶液稀释后PH变化大小判断;
B、根据溶液中氢氧根离子浓度进行判断;
C、若都是强碱,c(ROH)=10 c(MOH),而MOH是弱碱,部分电离出氢氧根离子;
D、碱溶液中,水电离的氢氧根离子浓度等于溶液中氢离子浓度.
B、根据溶液中氢氧根离子浓度进行判断;
C、若都是强碱,c(ROH)=10 c(MOH),而MOH是弱碱,部分电离出氢氧根离子;
D、碱溶液中,水电离的氢氧根离子浓度等于溶液中氢离子浓度.
解答:解:A、根据图示,溶液稀释100倍,MOH溶液的PH减小了1,ROH溶液PH减小了2,所以ROH是强碱,MOH是弱碱,故A错误;
B、两溶液中PH相等,氢氧根离子浓度等于c(M+)、c(R+),所以c(M+)=c(R+),故B错误;
C、由于ROH是强碱,MOH是弱碱,稀释前,MOH大于0.01mol/L,所以稀释前,c(ROH)<10 c(MOH),故C正确;
D、稀释前,两溶液中,水电离的氢氧根离子浓度大于溶液中氢离子浓度,所以MOH溶液中水电离的c(OH-)是ROH溶液中由水电离出的氢氧根离子浓度的10倍,故D错误;
故选C.
B、两溶液中PH相等,氢氧根离子浓度等于c(M+)、c(R+),所以c(M+)=c(R+),故B错误;
C、由于ROH是强碱,MOH是弱碱,稀释前,MOH大于0.01mol/L,所以稀释前,c(ROH)<10 c(MOH),故C正确;
D、稀释前,两溶液中,水电离的氢氧根离子浓度大于溶液中氢离子浓度,所以MOH溶液中水电离的c(OH-)是ROH溶液中由水电离出的氢氧根离子浓度的10倍,故D错误;
故选C.
点评:本题考查了根据图示判断碱溶液的强弱及比较溶液中水电离程度大小,本题难度不大,关键合理分析图示.

练习册系列答案
相关题目
 (2012?上海模拟)“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述错误的是( )
(2012?上海模拟)“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述错误的是( )