题目内容
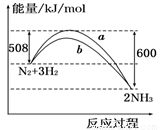
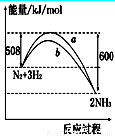
如图所示是298 K时N2与H2反应过程中 ,能量变化的
曲线图.下列叙述正确的是
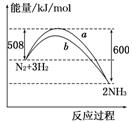
A.该反应的热化学方程式为:N2+3H2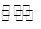 2NH3 ΔH=-92 kJ/mol
2NH3 ΔH=-92 kJ/mol
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,
若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
【答案】
D
【解析】略

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 2NH3 ΔH=-92 kJ/mol
2NH3 ΔH=-92 kJ/mol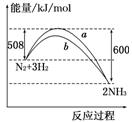
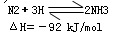
 2NH3 ΔH=-92 kJ/mol
2NH3 ΔH=-92 kJ/mol