题目内容
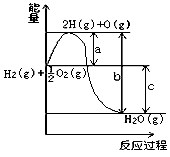
已知:H2(g)+
O2(g)═H2O(l)△H1=-285.8kJ?mol-1①
H2(g)═H2(l)△H2=-0.92kJ?mol-1②
O2(g)═O2(l)△H3=-6.84kJ?mol-1③
H2O(g)═H2O(l)△H4=-44kJ?mol-1④
下列说法正确的是( )
| 1 |
| 2 |
H2(g)═H2(l)△H2=-0.92kJ?mol-1②
O2(g)═O2(l)△H3=-6.84kJ?mol-1③
H2O(g)═H2O(l)△H4=-44kJ?mol-1④
下列说法正确的是( )
| A、上述四个反应都是吸热反应 | ||
| B、1mol液态H2的能量大于1mol气态H2的能量 | ||
| C、H2的燃烧热(△H)为-285.8kJ?mol-1 | ||
D、火箭中液氢燃烧的热化学方程式为H2(l)+
|
分析:A.△H<0,都为放热反应;
B.根据物质由液体变为气体吸收能量判断;
C.根据燃烧热的定义判断;
D.根据盖斯定律计算.
B.根据物质由液体变为气体吸收能量判断;
C.根据燃烧热的定义判断;
D.根据盖斯定律计算.
解答:解:A.△H<0,都为放热反应,故A错误;
B.物质由液体变为气体吸收能量,则1mol液态H2的能量小于1mol气态H2的能量,故B错误;
C.根据燃烧热的定义可知,1mol氢气完全燃烧生成液态水时最稳定,此时H2的燃烧热(△H)为-285.8kJ?mol-1,故C正确;
D.已知H2(g)+
O2(g)═H2O(l)△H1=-285.8kJ?mol-1①,H2O(g)═H2O(l)△H4=-44kJ?mol-1④,将①-④可得H2(l)+
O2(l)═H2O(g)△H=-241.8kJ?mol-1,故D错误.
故选C.
B.物质由液体变为气体吸收能量,则1mol液态H2的能量小于1mol气态H2的能量,故B错误;
C.根据燃烧热的定义可知,1mol氢气完全燃烧生成液态水时最稳定,此时H2的燃烧热(△H)为-285.8kJ?mol-1,故C正确;
D.已知H2(g)+
| 1 |
| 2 |
| 1 |
| 2 |
故选C.
点评:本题综合考查化学反应与能量变化知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握燃烧热的定义以及盖斯定律的应用,难度不大.

练习册系列答案
相关题目
已知:H2(g)+1/2O2(g)=H2O(l) △H =-285.83kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H =-282.9kJ/mol
若氢气与一氧化碳的混合气体完全燃烧可生成5.4克水(l),并放出114.3kJ的热量,则混合气中一氧化碳的物质的量为( )
|
A.0.22 mol |
B.0.15 mol |
|
C.0.1 mol |
D.0.05 mol |