题目内容
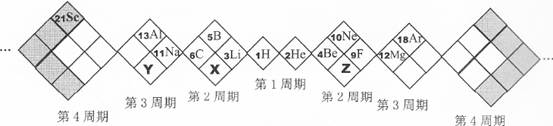
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:

(1)D原子结构示意图为 _______ ,A在周期表中的位置为 。
(2)B和C形成的化合物的电子式为 。
(3)B和D简单离子的半径大小为 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是 (填序号)。
a.比较两种单质的颜色
b.比较两种单质与H2化合的难易程度
c.依据两元素在周期表中的位置
d.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5,则该物质的化学式为 。

(1)D原子结构示意图为 _______ ,A在周期表中的位置为 。
(2)B和C形成的化合物的电子式为 。
(3)B和D简单离子的半径大小为 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是 (填序号)。
a.比较两种单质的颜色
b.比较两种单质与H2化合的难易程度
c.依据两元素在周期表中的位置
d.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5,则该物质的化学式为 。
(1)  第二周期第ⅤA族
第二周期第ⅤA族
(2)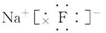 (3)F->Al3+
(3)F->Al3+
(4)a、e (5)NCl3
 第二周期第ⅤA族
第二周期第ⅤA族(2)
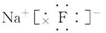 (3)F->Al3+
(3)F->Al3+(4)a、e (5)NCl3
A的最高正价与最低负价的绝对值之差为2,设A原子最外层有x个电子,则x-(8-x)=2,x=5,A为氮族元素。因为A、B、C、D、E的原子序数依次增大,A为N。C能与冷水反应,且1 mol C能够生成标准状况下11.2 L H2,C为Na。D在第三周期,且最外层电子数等于周期数,D为Al。E的负一价阴离子的电子层结构与Ar相同,E为Cl,B为F。
(1)Al的原子结构示意图为 ,N在元素周期表中的位置为第二周期第ⅤA族。
,N在元素周期表中的位置为第二周期第ⅤA族。
(2)B与C形成的化合物为NaF,电子式为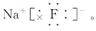
(3)F-与Al3+电子层数相同,但是核电荷数F-小于Al3+,所以离子半径F- >Al3+。
(4)比较非金属性的强弱可以通过同主族元素的性质递变来分析,c对;阴离子的还原性越弱,单质的氧化性越强,元素非金属性越强,所以d对;还可以根据单质与H2化合的难易程度来比较,b对;但是不能根据单质的颜色和最高价氧化物对应水化物的酸性强弱来比较,因为F没有含氧酸,a、e不可行。
(5)因为Cl与另外四种元素中的一种形成的化合物中原子数之比为1∶3。若另一种元素的原子为3,则该原子的相对原子质量为(120.5-35.5)/3≈28.3,N、F、Na、Al都不符合,因此应为Cl原子数为3,则另一种原子的相对原子质量为120.5-35.5×3=14,所以另一种元素为N,该化合物的化学式为NCl3
(1)Al的原子结构示意图为
 ,N在元素周期表中的位置为第二周期第ⅤA族。
,N在元素周期表中的位置为第二周期第ⅤA族。(2)B与C形成的化合物为NaF,电子式为
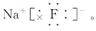
(3)F-与Al3+电子层数相同,但是核电荷数F-小于Al3+,所以离子半径F- >Al3+。
(4)比较非金属性的强弱可以通过同主族元素的性质递变来分析,c对;阴离子的还原性越弱,单质的氧化性越强,元素非金属性越强,所以d对;还可以根据单质与H2化合的难易程度来比较,b对;但是不能根据单质的颜色和最高价氧化物对应水化物的酸性强弱来比较,因为F没有含氧酸,a、e不可行。
(5)因为Cl与另外四种元素中的一种形成的化合物中原子数之比为1∶3。若另一种元素的原子为3,则该原子的相对原子质量为(120.5-35.5)/3≈28.3,N、F、Na、Al都不符合,因此应为Cl原子数为3,则另一种原子的相对原子质量为120.5-35.5×3=14,所以另一种元素为N,该化合物的化学式为NCl3

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目