题目内容
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。某化学实验小组进行如下有关SO2性质的探究活动。

(1)装置A中反应的离子方程式为 。
(2)选用图1以上装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是 。
②丙同学设计的合理实验方案为:按照A→C →尾气处理(填字母)顺序连接装置。其中装置C的作用是 。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是 。
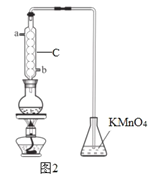
(3)利用如图2的装置A测残液中SO2的含量。量取10.00 mL残液于圆底烧瓶中,加热使SO2全部蒸出,用20.00 mL 0.1000 mol/L的KMnO4标准溶液吸收。充分反应后,再用0.2000 mol/L的KI溶液滴定过量的KMnO4,消耗KI溶液25.00 mL。
(已知:5SO2+2MnO4-+2H2O==2Mn2++5SO42-+4H+,10I-+2MnO4-+16H+==2Mn2++5I2+8H2O)
①该装置中仪器C的名称为 ,水通入C的进口为_____________。
②残液中SO2的含量为 mol·L-1。
【答案】(1)CaSO3+2H+=Ca2++SO2↑+H2O(2分)(2)①二氧化硫通入次氯酸钙溶液发生了氧化还原反应不能证明强酸制备弱酸的原理(2分)②B→E→D→F(2分);除去HCl气体以免影响后面的实验测得(2分)装置D中品红溶液不褪色,F中出现白色沉淀(2分)(3)①球形冷凝管(1分)b(1分)②0.2500(2分)
【解析】
试题分析:(1)装置A制备SO2,反应的离子方程式为CaSO3 + 2H+ = Ca2+ + SO2↑ + H2O;
(2)①按照A→C→F顺序连接装置,其中饱和的亚硫酸氢钠除去HCl,二氧化硫通入次氯酸钙溶液发生了氧化还原反应,不能证明强酸制备弱酸的原理,不能证明亚硫酸和次氯酸的酸性强弱;
②次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断.A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中,则装置连接顺序为A、C、B、E、D、F,其中装置C的作用是除去HCl气体,D中品红不褪色,F中出现白色沉淀,可证明亚硫酸的酸性强于次氯酸;
(3)①装置C的名称是球形冷凝管;采取逆流原理通入冷凝水,即球形冷凝管进水口为b;
②与高锰酸钾反应的KI的物质的量是0.2000mol/L×0.025L=0.005mol,则消耗高锰酸钾是0.001mol,因此与SO2反应的高锰酸钾是0.002mol-0.001mol=0.001mol,因此消耗SO2是0.001mol×2.5=0.0025mol,所以SO2的含量为0.0025mol÷0.01L=0.2500mol/L。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案