题目内容
【题目】A、B、C、D 是同一周期的四种元素。A、B、C 的原子序数依次相差为 1,A 元素的单质的化 学性质活泼,A 元素的原子在本周期中第一电离能最小。B 元素的氧化物 2.0g 恰好跟 100mL 0.5molL1硫酸完全反应。B 元素单质跟 D 元素单质反应生成化合物 BD2。根据以上事实,填写下列空白:
(1)A 的原子结构示意图:_____,C 原子的电子式为_____;
(2)BD2 的电子式为_____;若向 C 的氧化物的水化物中加入 A 的氧化物的水化物,则溶液 显碱性。这一反应的离子方程式是_________。
【答案】 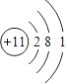
![]()
![]() Al(OH)3+ OH-== AlO2-+2H2O
Al(OH)3+ OH-== AlO2-+2H2O
【解析】A、B、C、D是同一周期的四种元素,A元素的原子在本周期中第一电离能最小,则A处于ⅠA族,A、B、C的原子序数依次相差为1,则B处于ⅡA族、C处于ⅢA族,B的氧化物能与酸反应,其氧化物中B显+2价,B元素的氧化物2.0g恰好跟100mL0.5molL-1硫酸完全,则BO的物质的量等于硫酸的物质的量为0.1L×0.5mol/L=0.05mol,则BO的相对分子质量=![]() =40g/mol,则B的相对原子质量为40-16=24,所以B是Mg元素,则A是Na元素,C是Al元素;B元素单质跟D元素单质反应生成化合物BD2,则化合物中D表现-1价,则D为Cl元素。
=40g/mol,则B的相对原子质量为40-16=24,所以B是Mg元素,则A是Na元素,C是Al元素;B元素单质跟D元素单质反应生成化合物BD2,则化合物中D表现-1价,则D为Cl元素。
(1)A为Na元素,原子核外有11个电子,其原子结构示意图为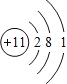 ,C为Al元素,铝原子的电子式为
,C为Al元素,铝原子的电子式为![]() ,故答案为:
,故答案为: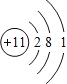 ;
;![]() ;
;
(2)MgCl2 的电子式为![]() ,C的氧化物的水化物为Al(OH)3,A的氧化物的水化物为NaOH,二者反应生成NaAlO2与水,反应的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O,反应的离子方程式为Al(OH)3 + OH-== AlO2- +2H2O,故答案为:
,C的氧化物的水化物为Al(OH)3,A的氧化物的水化物为NaOH,二者反应生成NaAlO2与水,反应的化学方程式是Al(OH)3+NaOH=NaAlO2+2H2O,反应的离子方程式为Al(OH)3 + OH-== AlO2- +2H2O,故答案为:![]() ;Al(OH)3 + OH-== AlO2- +2H2O。
;Al(OH)3 + OH-== AlO2- +2H2O。

【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是 I1=738 kJ/mol;I2=1 451 kJ/mol;I3=7 733 kJ/mol;I4=10 540 kJ/mol |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式______________________________。
(2)B基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为![]() 该同学所画的电子排布图违背了_____________________________________。
该同学所画的电子排布图违背了_____________________________________。
(4)G位于________族________区,价电子排布式为________。
(5)检验F元素的方法是________,请用原子结构的知识解释产生此现象的原因是_____________________________________________________________。